Биохимия аминокислот - А. Майстер 1961
Природные аминокислоты
Вопросы стереохимии аминокислот
Аспарагин был первой аминокислотой, выделенной из природного сырья [14], и одной из первых аминокислот, у которых обнаружено наличие оптической активности. Свыше ста лет назад Пастер [446, 447] нашел, что природный аспарагин вращает плоскость поляризации влево, тогда как аспарагиновая кислота, полученная в результате гидролиза природного аспарагина, представляет собой правовращающее соединение, а аспарагиновая кислота, полученная путем химического синтеза, оптически неактивна. Поводом к этим исследованиям Пастера, по-видимому, послужило утверждение Дессеня, что аспарагиновая кислота, полученная химическим путем из фумаровой кислоты и аммиака, идентична природной аспарагиновой кислоте [448]. Пастер со всей настойчивостью подчеркивал, что природная и синтетическая аспарагиновые кислоты неидентичны, но от него в то время ускользнул тот факт, что синтетический продукт представляет собой рацемическую смесь двух изомеров, подобно рацемической форме винной кислоты, которую он сам ранее изучил.
Лишь спустя 34 года Шульце и Босхард [449, 450] показали, что оптически неактивные аминокислоты представляют собой смеси равных количеств право- и левовращающих форм. Эти авторы нашли, что 1) при щелочном гидролизе белков образуются оптически неактивные аминокислоты; 2) такие аминокислоты отличаются по растворимости от оптически активных аминокислот, полученных при кислотном гидролизе белка, и 3) при обработке оптически активных аминокислот баритом при высокой температуре они утрачивают свою оптическую активность. Если ввести такую оптически неактивную аминокислоту в состав питательной среды для выращивания плесени, то по окончании роста микроорганизма из среды можно выделить оптически активную аминокислоту.
Рацематы лейцина и глутаминовой кислоты подвергали воздействию растущей культуры Penicitlium glaucum, которая, как ранее установил Пастер [451, 452], использует в основном правовращающий изомер винной кислоты. Оптическое вращение лейцина и глутаминовой кислоты, выделенных из среды после роста микроорганизма, было противоположно по знаку и примерно равно по величине оптическому вращению препаратов лейцина и глутаминовой кислоты, полученных из продуктов кислотного гидролиза белков.
Ныне известно, что аминокислоты, обычно встречающиеся в белковых гидролизатах (за исключением глицина), оптически активны, причем все они имеют одинаковую конфигурацию у а-углеродного атома, а именно L-конфигурацию.
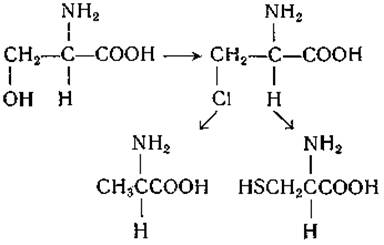
Это заключение основано на данных, полученных тремя различными путями. Во-первых, удается осуществить взаимопревращения некоторых аминокислот или превратить их в идентичные продукты, используя реакции, в которых а-углеродный атом не участвует. Примером может служить превращение L-серина в L-аланин и в L-цистеин, осуществленное Фишером и Раске [453]:
В основе другого ряда доказательств лежит исследование зависимости оптического вращения аминокислот от степени их ионизации и от длины волны поляризованного света [454]. Так, например, а-аминокислоты (и а-оксикислоты) L-конфигурации имеют большее положительное оптическое вращение в кислом растворе, чем в воде (табл. 5). Наконец, представление о том, что аминокислоты, выделенные из белков, имеют одинаковую конфигурацию, подтверждается данными, полученными при использовании ферментов, обладающих оптической специфичностью.
В старой литературе направление оптического вращения аминокислот обозначали малыми буквами d (dextro, или правое) и I (levo, или левое), указывающими на направление вращения в водном растворе. Позднее, когда выяснилось, что аминокислоты, выделенные из белков, имеют одинаковую конфигурацию, для обозначения аминокислот «природного» стерического ряда стали использовать приставку l, а направление вращения обозначать знаками (+) и (—), заключенными в круглые скобки, например l(—)-аланин, l(+) глутаминовая кислота. Использование двух систем обозначения в ряде случаев приводило к путанице, которая усугублялась тем, что одни природные аминокислоты имеют левое, а другие — правое вращение. Кроме того, у некоторых аминокислот знаки оптического вращения в водном растворе и в присутствии кислоты противоположны. Дополнительные трудности возникли в отношении аминокислот, в молекуле которых имеется более одного асимметрического атома углерода. Примером может служить выделенный из белка треонин, который сперва был обозначен как d(—)-треонин ввиду его родства с D-треозой.
Для унификации номенклатуры аминокислот была предложена новая система, согласно которой для обозначения конфигурации а-углеродного атома используют прописные буквы L и D [455, 456]. Эта система обозначений почти полностью вытеснила старую; однако и по сей день в связи с обозначениями аминокислот в литературе иногда возникают неясности. Когда конфигурация аминокислоты неизвестна, ей обычно придают обозначение d или l в зависимости от знака ее оптического вращения в водном растворе1; при этом следует указывать растворитель, применяемый при определении оптического вращения. В табл. 5, 6 и 7 приведены величины оптического вращения в воде и в соляной кислоте для аминокислот, обычно встречающихся в белках, а также для других аминокислот.
Таблица 5 Удельное оптическое вращение (при 25° ±1°) аминокислот, обычно встречающихся в белковых гидролизатах
|
L-Аминокислота |
[a]D (в H2O) |
[a]D (в 5 н. НСl) |
|
Аланин * |
+ 1,8 |
+14,6 |
|
Аргинин |
+12,5 |
+27,6 |
|
Аспарагин |
+33,2 ** |
|
|
Аспарагиновая кислота * |
+ 5,0 |
+25,4 |
|
Валин * |
+ 5,6 |
+28,3 |
|
Гистидин * |
—38,5 |
+ 11,8 |
|
Глутамин |
+ 6,3 |
+31,8*** |
|
Глутаминовая кислота* |
+12,0 |
+31,8 |
|
Изолейцин * |
+12,4 |
+39,5 |
|
Лейцин * |
—11,0 |
+ 16,0 |
|
Лизин * |
+ 13,5 |
+26,0 |
|
Метионин * |
—10,0 |
+23,2 |
|
4-Оксипролин |
—76,0 |
—50,5 |
|
Пролин * |
—86,2 |
—60,4 |
|
Серин * |
— 7,5 |
+15,1 |
|
Тирозин * |
—10,0 |
|
|
Треонин * |
—28,5 |
—15,0 |
|
Триптофан * |
—33,7 |
+ 2,8 *** |
|
Фенилаланин * |
—34,5 |
— 4,5 |
|
Цистеин * |
—16,5 |
+ 6,5 |
|
Цистин * |
—232 |
* Определения произведены с использованием изомероз, полученных путем ферментативного расщепления рацематов [58 5].
** В 3 н. НСl.
*** В 1 н. НСl.
1 Предпочтительно пользоваться в этих случаях знаками (+) и (—) в круглых скобках. — Прим. ред.
Таблица 6 Удельное оптическое вращение других природных аминокислот
|
Аминокислота |
[a]D (в НCl) |
[a]D (в 5 н. НСl) |
|
(+)-5-Аллил+-цистеинсульфоксид |
+62,8 |
|
|
L-a-A миноадипиновая кислота * |
+ 3,2 |
+25,0 |
|
L-a-Аминомасляная кислота * |
+ 9,3 |
+20,6 |
|
L-Гомосерин* |
— 8,8 |
+ 18,3 |
|
L-Дженколовая кислота |
—44,5 ** |
|
|
L-a,у-Диаминомасляная кислота * |
+ 7,2 |
+31,7 |
|
LL-а,ε-Диаминопимелиновая кислота *............... |
+ 8,1 |
+45,1 |
|
L-a, ß-Диаминопропионовая кислота * |
0 |
+34,0 |
|
3,5-Дийод-L-тирозин |
+ 2,9*** |
|
|
L-Канаванин |
+ 7,9 |
|
|
О-Карбамил-D-cepин |
+ 2,0 |
—19,6 *** |
|
L-Кинуренин |
—30,5 |
|
|
а-Метил-D-cepин* |
+ 4,5 |
+ 2,0 |
|
(+)-S-Метил-L-цистеинсульфоксид |
+125 |
+ 168*** |
|
5-Окси-L-лизин * |
+ 9,2 |
+17,8 |
|
алло-Окси-L-пролин |
—59,5 |
—18,8 |
|
L-Орнитин* |
+ 12,1 |
+28,4 |
|
D-Пеницилламин |
—56,0 |
|
|
L-Пипеколиновая кислота ...................... |
—24,6 |
|
|
L-Тироксин |
—4,4****** |
|
|
L-Теанин |
+ 6,3 |
|
|
D-Циклосерин |
+116 |
|
|
L-Цистатионин |
23,7 *** |
|
|
L-Цитруллин * |
+ 4,0 |
+24,2 |
* Определения произведены с использованием изомеров, полученных путем ферментативного расщепления рацематов [585].
** В 1-процентной НСl.
*** В 1,1 н. НСl.
**** В 1 н. HCl
***** В 1-процентном (в расчете на свободную аминокислоту) растворе хлоргидрата аминокислоты в 1 н. NaOH.
****** B 0,13 н. растворе NaOH в 70-процентном спирте.
Таблица 7 Удельное оптическое вращение некоторых аминокислот
|
L-Аминокислота |
[a]D (в H2O) |
[a]D ( в 5 н. НСl) |
|
Аллилглицин * |
—37,1 |
—5,7 |
|
а-Аминогептановая кислота * |
+6,8 |
+23,3 |
|
а-Амино-δ-окси-н-валерьяновая кислота * |
+6,0 |
+28,8 |
|
а-Амино-ε-окси-н-капроновая кислота * |
+4,0 |
+23,7 |
|
а-Аминокаприловая кислота * |
+9,1 |
+23,0 |
|
а-Аминотрикарбаллиловая кислота (А) * |
+7,5 |
+36,4 |
|
а-Аминотрикарбаллиловая кислота (В) * |
—32,8 |
—48,0 |
|
а-Аминофенилуксусная кислота * |
+ 114 |
+168 |
|
а-Аминоциклогексилуксусная кислота * |
+6,7 |
+35,5 |
|
а-Аминоциклогексилпропионовая кислота * |
—9,0 |
+15,0 |
|
Гомоглутамин |
+2,6 |
+21,0 ** |
|
Гомолантионин |
+37,3 |
|
|
Гомоцистин * |
+78,0 |
|
|
Изовалин * |
+11,2 |
+6,7 |
|
алло-Изолейцин * |
+15,9 |
+39,6 |
|
Лантионин |
+43,8 *** |
|
|
трет-Лейцин * |
—9,7 |
+7,4 |
|
Норвалин * |
+7,0 |
+24,1 |
|
Норлейцин * |
+4,7 |
+24,5 |
|
алло-5-Оксилизин * |
+ 10,9 |
+31,4 |
|
ß-2-Тиенилаланин |
—31,7 |
|
|
алло-Треонин * |
+10,0 |
+31,7 |
|
ß-Фенилсерин * |
—33,1 |
—50,3 |
|
алло-β-Фенилсерин * |
+8,2 |
+81,3 |
|
алло-Цистатионин |
—25,0 ** |
|
|
Этионин * |
—9,2 |
+23,7 |
* Определения произведены на изомерах, полученных путем ферментативного расщепления рацематов [585].
** В 1 н. НСl.
*** В 2-процентном водном растворе, содержащем 1 эквивалент NaOH.
Следует отметить, что даже использование прописных букв D и L не всегда однозначно. Так, маннозаминовую кислоту, полученную из D-маннозы, строго говоря, следует считать D-маннозаминовой кислотой, однако это соединение в то же время является L-аминокислотой. Во избежание двусмысленности к литерам D и L приписывают справа подстрочные индексы «s» (вместо serine) и «g» (вместо glyceraldehyde). Так, Dg-маннозаминовая кислота = Ls-маннозаминовая кислота.
Молекула D-глицеринового альдегида, условно принятая за исходную структуру (эталон сравнения), с которой сопоставляют конфигурацию сахаров, может быть превращена химическим путем без изменения конфигурации в (+)-яблочную кислоту, (—)-молочную кислоту и (+)-винную кислоту. Молекула L-серина — левовращающего серина, обычно присутствующего в белках, была произвольно избрана в качестве эталона сравнения при определении конфигурации аминокислот.
Оба эталона согласуются друг с другом: идентичность конфигураций D-глицеринового альдегида и D-серина была однозначно доказана осуществлением следующего ряда химических реакций [457—460]:
![]()
Абсолютная оптическая конфигурация рассмотренных выше аминокислот была установлена на основании данных, полученных методом дифракции рентгеновых лучей и другими методами [461, 462]. Эти данные подтвердили, что условные обозначения, предложенные Фишером, совпадают с истинной абсолютной конфигурацией. Так, молекулы Dg-глицеринового альдегида и Ls-серина имеют следующую конфигурацию:

Молекулы большинства природных аминокислот обладают лишь одним асимметрическим атомом, имеющим L-конфигурацию, но некоторые природные аминокислоты имеют более одного асимметрического атома углерода и поэтому существуют более чем в двух стереоизомерных формах. В качестве примера можно привести следующие формулы изомеров изолейцина.
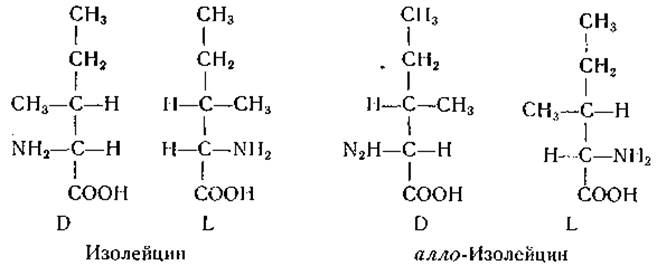
ß-Углеродный атом L-изолейцина имеет L-конфигурацию [463—466], а ß-углеродный атом L-треонина — D-конфигурацию [467]. В окси-L-пролине и его зеркальном изомере гидроксильная группа находится в транс-положении по отношению к карбоксильной группе, а в соответствующих алло-формах — в цис-положении [468—470].

y-Углеродный атом окси-L-пролина (и алло-окси-D-пролина) имеет L-конфигурацию; такой вывод вытекает из соображений, основанных на исследовании взаимоотношений между стереоизомерами оксиорнитина и оксипролина [586, 587]:
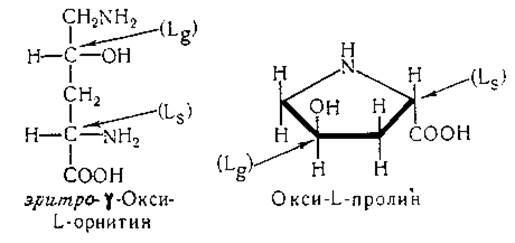
Конфигурация второго асимметрического центра δ-oкси-L- лизина в настоящее время окончательно не выяснена, однако на основании имеющихся данных предполагают, что этот асимметрический центр имеет L-конфигурацию. Такую же конфигурацию имеют оба асимметрических углеродных атома природной δ-оксипипеколиновой кислоты [586, 588].
Природный октопин, как известно, содержит в своей молекуле остатки D-аланина и L-аргинина (стр. 57). Метилпроизводное лантионина, полученное из субтилина, содержит, по-видимому, D-a-аминомасляную кислоту и L-аланин, конфигурация же третьего асимметрического атома углерода еще не известна (стр. 53). Природная аргининоянтарная кислота, канаваноянтарная кислота и цистатионин имеют, вероятно, L-конфигурацию.
Молекулы некоторых аминокислот встречаются во внутренне компенсированной или мезо-форме. Так, например, при рацемизации цистина в кислом растворе образуется (наряду с небольшим количеством DL-цистеина) мезо-форма, которая не может быть разделена на оптически активные формы приемами, которые позволяют разделить DL-цистин [471, 472]. Получены также мезо-формы лантионина [242—245], гомолантионина [473] и цистатионина [474]. Мезо-а,ε-диаминопимелиновая кислота выделена из бактерий (стр. 51), но в природе она встречается также в LL-форме [475]; синтезированы мезо-, DD- и LL-формы этой кислоты [476]. При химическом расщеплении стрептомицина получена а, у-диамино-β-оксиглутаровая кислота, которая может существовать, в двух мезо- и одной рацемической формах [477]. Конфигурация природной а, ε-диамино-β-оксипимелиновой кислоты не известна. Для этой аминокислоты, а также для метального производного лантионина, выделенного из субтилина (стр. 53), возможны две мезо-формы.
Ряд аминокислот, представляющих интерес для биохимиков, не встречается в природе. Некоторые из них были разделены на оптические изомеры и использованы в биохимических исследованиях. Осуществлен химический синтез β-оксиглутаминовой кислоты, "которая одно время считалась составной частью белков (стр. 11). Получены рацематы двух диастереоизомеров этого соединения [478, 479]. Один из них — алло-β-оксиглутаминовая кислота, по-видимому, легче поддается ферментативному декарбоксилированию, чем другой (стр. 205). Имеются данные, указывающие на то, что декарбоксилазы алло-ß-оксиглутаминовой и глутаминовой кислот не идентичны [480].

Существование особой декарбоксилазы алло-β-оксиглутаминовой кислоты как будто свидетельствует о наличии этой аминокислоты в природе. Однако ввиду того, что при повторном исследовании природного продукта, в котором предполагали β-оксиглутаминовую кислоту, последнюю не обнаружили [320], для подтверждения наличия этой аминокислоты в биологических объектах необходимы новые доказательства [320].
Путем синтеза приготовлена а-аминотрикарбаллиловая кислота — аминоаналог изолимонной и щавелевоянтарной кислот — и получены ее четыре изомера [481]. Последние путем обработки азотистой кислотой были переведены в изомерные изолимонные кислоты. При действии азотистой кислоты на один из левовращающих изомеров а-аминотрикарбаллиловой кислоты, имеющий L-конфигурацию [481], образуется природная d-изолимонная кислота. Последняя подвергается действию дегидрогеназы изолимонной кислоты [482]; ее углеродный атом, очевидно, имеет L-конфигурацию. Что касается ß-углеродного атома изолимонной кислоты, то он, очевидно, обладает D-конфигурацией [483]. Получены также 4 изомера ß-фенилсерина [484—487]. Эта аминокислота не встречается в природе, однако ее D-трео-изомер в стереохимическом отношении близок к антибиотику хлорамфениколу (левомицетину) (стр. 76).
На оптические изомеры разделен и ряд других неприродных DL-аминокислот, в том числе норвалин (а-аминовалерьяновая кислота), норлейцин (а-аминокапроновая кислота), трет-лейцин (ß, ß'-диметил-а-аминомасляная кислота), изовалин (а-метил-а-аминомасляная кислота), этионин (а-амино-у-этилтиомасляная кислота), ß-2-тиенилаланин, а-фенилглицин, а-циклогексилглицин, ß-циклогексилаланин, аллилглицин и др. Не исключено, что та или иная из перечисленных аминокислот когда-нибудь будет обнаружена в природных продуктах; ведь многие аминокислоты, например аланин [2], а, ß-диаминопропионовая кислота [488], у-аминомасляная кислота [489], а,ε-диаминопимелиновая кислота [490] и аспарагиновая кислота [448], были сперва получены синтетически и лишь позднее распознаны среди природных продуктов.
Специальные вопросы возникают при выборе обозначения аминокислот, в молекуле которых имеется а-метильная группа [491]. Например, в (+)-изовалине метальная группа занимает то же положение в пространстве, что и а-водородный атом в молекуле L-a-аминомасляной кислоты. Но вместе с тем можно рассматривать (+)-изовалин как D-аланин, в котором водородный атом замещен этильной группой:

Поэтому правовращающий изовалин можно обозначить либо как а-метил-L-а-аминомасляную кислоту, либо как а-этил-D-аланин. Удельное оптическое вращение (+)-изовалина составляет +13,1° в воде и +7,8° в соляной кислоте; такое направление изменений удельного вращения типично для аминокислот D-ряда. Однако молярное вращение (+)-изовалина в ледяной уксусной кислоте больше, чем в воде, что характерно для L-аминокислот.
Хлорацетил-(+)-изовалин гидролизуется ацилазой почек, а его энантиоморфное производное устойчиво к действию этого фермента. На основе данных подобных исследований (+)-изовалин следует обозначать как L-изовалин. Применение этого биологического критерия для определения оптической конфигурации, по-видимому, вполне оправдано, но из сказанного выше видно, какие трудные задачи возникают при установлении конфигурации а-алкил-а-аминокислот.
Заслуживает внимания вопрос об изомерии S-стереоизомеров метионинсульфоксида [492]. В молекуле метионинсульфоксида атом серы представляет дополнительный центр асимметрии, а потому возможны 4 изомера этого соединения. Были получены: L-метионин-l-сульфоксид, L-метионин-d-сульфоксид и соответствующий d-сульфоксид. Имеются указания на то, что d- и l-изомеры сульфоксида различаются по биологической активности (стр. 149). Примером природной аминокислоты, в молекуле которой имеется асимметрический атом серы, служит аллиин (стр. 54).
Известны и другие типы стереоизомерии. Например, введение в молекулу атома изотопа может привести к возникновению асимметрического атома углерода. Подобный тип изомерии возможен для молекулы серина, содержащей два атома дейтерия [589]:
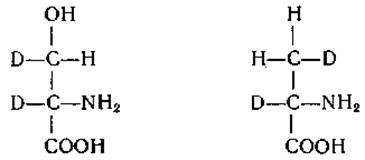
В этом отношении представляют интерес исследования, касающиеся ферментативного декарбоксилирования аминокислот в среде D2O (стр. 257). Наконец, следует указать, что идентичные группы полностью симметричных молекул, например лимонной кислоты, ведут себя по-разному в ферментативных и неферментативных реакциях с оптически активными соединениями. Этот тип асимметрии и реакции подобных веществ были подробно рассмотрены Шварцем и Картером [493].