Биохимия аминокислот - А. Майстер 1961
Природные аминокислоты
Аминокислоты, обычно встречающиеся в белках
Аминокислотный состав белков
«...Свойства белка не являются отражением суммы свойств составляющих его компонентов, но они определяются структурой его молекулы... Мы можем получить некоторое представление о возможном разнообразии в сочетаниях составных частей белка, если вспомним, что число этих последних соответствует числу букв английского алфавита, посредством которых можно выразить бесконечный ряд мыслей». Коссель (1911).
Гидролиз белка производится при помощи кислот (соляной, серной, йодистоводородной), щелочей (гидроокись натрия или бария) или протеолитических ферментов. Серная кислота была использована Браконно в 1820 г. [46] для гидролиза желатины. В дальнейшем стали пользоваться соляной кислотой [15], применение которой в настоящее время общепринято. Обычная процедура гидролиза заключается в обработке белка 5—20-кратным по весу количеством 3—12 н. соляной кислоты при 100— 120° в течение 3—40 час. После гидролиза избыток соляной кислоты удаляют многократным выпариванием. Для разделения смеси хлоргидратов аминокислот существует ряд способов: осаждение аминокислот относительно специфическими реагентами, получение и разделение производных аминокислот (эфиров, солей серебра или меди), методы электрофореза, ионофореза и хроматографии. Последний метод оказался весьма ценным и будет подробно рассмотрен ниже (стр. 40).
Гидролиз белков кислотой обычно сопровождается разрушением (в результате окисления) большей части триптофана, окислением цистеина в цистин и некоторым распадом серина и треонина. Щелочной гидролиз имеет то преимущество перед кислотным, что триптофан в этих условиях более стабилен. Однако при щелочном гидролизе имеет место интенсивный распад серина, треонина, цистина, цистеина и аргинина. Кроме того, при щелочном гидролизе наблюдается рацемизация природных аминокислот. Гидролиз белка как кислотой, так и щелочью сопровождается дезамидированием глутамина и аспарагина. Эти амиды аминокислот и триптофан можно выделить из гидролизатов, полученных при помощи протеолитических ферментов. Однако ферментативный метод также страдает определенными недостатками: в частности, гидролиз может быть неполным и сам фермент может распадаться с освобождением аминокислот. Выделение аминокислот из белков и получение их с количественным выходом представляет очень сложную задачу, которой занимались многие исследователи. Эта обширная область всесторонне рассмотрена в монографии Блока и Боллинг [98].
Недавно для гидролиза белка было рекомендовано применение ионообменных смол. По одной из методик казеин гидролизуют путем кипячения с обратным холодильником в присутствии сильного катионита (дауэкс-50); образующиеся при гидролизе аминокислоты связываются смолой и могут быть освобождены путем обработки смолы баритом [571, 572].
Белки, как известно, сильно различаются по аминокислотному составу; по этому вопросу накопилась уже большая литература [98—101, 571, 572]. Исследование аминокислотного состава белков оказалось довольно сложной задачей, так как существует ряд трудностей, связанных с приготовлением чистых белков и последующим количественным выделением продуктов их гидролиза.
Несмотря на значительные усилия многих исследователей, до сих пор получено сравнительно мало данных, позволяющих правильно толковать строение белков. Совершенно очевидно, что свойства белка не могут определяться лишь суммой свойств составляющих его аминокислот. Тем не менее знание аминокислотного состава белка является основной предпосылкой, необходимой для успешного выяснения порядка расположения аминoкислот и других особенностей строения белка. Данные об аминокислотном составе белков имеют существенное значение для решения практических вопросов, связанных с проблемой питания, а также для понимания физических и химических свойств очищенных белков.
Хотя детальное рассмотрение химии белков не входит в задачу этой книги, интересно все же обсудить аминокислотный состав некоторых белков. До настоящего времени подвергнуты анализу более 50 белков, однако полученные результаты не позволяют сделать сколько-нибудь широких обобщений. Тем не менее исследование белков, обладающих специфическими функциями, выявило целый ряд их характерных особенностей. Некоторые примеры из литературы приведены в табл. 1.
Пытаясь найти некоторые общие принципы, лежащие в основе аминокислотного состава белков, Бейли [101] построил ряд гистограмм, отражающих аминокислотный состав двух десятков белков. В целом Бейли не был удовлетворен результатами этой попытки, но ему все же удалось сделать некоторые заключения. Например, он указал на широкое распространение валина, лейцина и изолейцина b отметил, что белки обычно содержат меньше изолейцина, чем лейцина. В белках обычно присутствуют фенилаланин, пролин, тирозин, аспарагиновая кислота, глутаминовая кислота и цистин, тогда как триптофан, метионин, лизин, гистидин, аргинин, глицин и аланин встречаются реже.
Тристрам [99] применил этот подход к некоторым другим белкам и заключил, что «некоторые группы аминокислот распределяются в белках таким образом, что гистограммы последних носят характер одной или нескольких частично перекрывающихся кривых нормального распределения. Если такое распределение отражает какую-то природную закономерность, то это может указывать либо на то, что механизм синтеза белка более или менее одинаков для всех видов клеток, либо скорее на то, что механизмы синтеза избирательны и не допускают образования любых стереохимически возможных белков».
Разработка хроматографических методов исследования белков и новых способов выяснения порядка чередования аминокислот позволяет ожидать, что в будущем данные по аминокислотному составу белков можно будет использовать более широко.
Некоторые белки отличаются своеобразными особенностями аминокислотного состава. Так, например, сальмин, принадлежащий к группе протаминов, характеризуется высоким содержанием аргинина и отсутствием таких распространенных компонентов белков, как глутаминовая кислота и лейцин, хотя в нем присутствуют остатки изолейцина и валина (см. табл. 1). Кератин шерсти отличается высоким содержанием цистина, в фиброине шелка имеется относительно большое количество глицина, аланина и серина, а коллаген является единственным белком, содержащим оксипролин и оксилизин. Уже давно известно, что тиреоглобулин содержит тироксин и дийодтирозин, а в последнее время найдено, что в состав тиреоглобулина могут входить и другие йодсодержащие аминокислоты. Приведенные примеры дают представление о характерном аминокислотном составе некоторых известных белков.
Таблица 1 Аминокислотный состав некоторых белков [99]
|
Аминокислоты |
Сальмин * |
Инсулин быка * |
Тиреоглобулин быка ** (0,54% дийодтирозина и 0,21%тироксина) |
Гемогло бин лошади * |
Сывороточный альбумин человека * |
y-Глобулин человека ** |
а-Казеин ** |
Пепсин * |
Кератин шерсти ** |
Фиброин шелка ** |
Коллаген ** |
|
Аланин |
1 |
3 |
83,1 |
54 |
42,8 |
46,4 |
334,0 |
106,9 |
|||
|
Аргинин |
40 |
1 |
73,2 |
14 |
25 |
27,9 |
24,7 |
2 |
59,7 |
6,3 |
49,4 |
|
Аспарагиновая кислота |
0 |
3 |
— |
51 |
46 |
66,2 |
63,2 |
41 |
54,1 |
20,8 |
47,3 |
|
Валин |
2 |
5 |
12,4 |
50 |
45 |
83,0 |
53,9 |
21 |
39,7 |
30,8 |
29,1 |
|
Гистидин |
0 |
2 |
14,4 |
36 |
16 |
16,1 |
18,7 |
2 |
6,8 |
2,3 |
4,8 |
|
Глицин |
3 |
4 |
50,7 |
48 |
15 |
56,0 |
30,2 |
29 |
87,0 |
581,0 |
363,0 |
|
Глутаминовая кислота |
0 |
7 |
— |
38 |
80 |
80,4 |
153,1 |
28 |
96,0 |
14,7 |
77,0 |
|
Изолейцин |
1 |
1 |
_ |
0 |
9 |
20,6 |
28 |
8,4 |
|||
|
Лейцин |
0 |
6 |
97,8 |
75 |
58 |
71,0 |
109,2 |
27 |
86,3 |
7,0 |
42,8 |
|
Лизин |
0 |
1 |
23,5 |
38 |
58 |
55,5 |
61,0 |
2 |
18,9 |
4,7 |
30,7 |
|
Метионин |
0 |
8,7 |
4,5 |
6 |
7,3 |
16,8 |
4 |
4,7 |
5 4 |
||
|
Оксилизин |
0 |
||||||||||
|
Оксипролин |
0 |
107 |
|||||||||
|
Пролин |
4 |
1 |
— |
22 |
31 |
70,5 |
65,1 |
15 |
82,6 |
6,4 |
131,3 |
|
Серин |
7 |
3 |
10,3 |
35 |
22 |
108,8 |
60,0 |
40 |
95,4 |
154,3 |
32,3 |
|
Тирозин |
0 |
4 |
17,2 |
11 |
18 |
37,6 |
44,8 |
16 |
25,7 |
70,7 |
5,5 |
|
Треонин |
0 |
1 |
— |
24 |
27 |
70,6 |
41,1 |
28 |
53,9 |
13,5 |
19,2 |
|
Триптофан |
0 |
10,2 |
5 |
1 |
14,2 |
7,9 |
4 |
8,8 |
0 |
0 |
|
|
Фенилаланин |
0 |
3 |
40,5 |
30 |
33 |
27,9 |
27,9 |
13 |
22,1 |
20,4 |
15,2 |
|
Цистеин |
0 |
— |
3 |
4 |
5,8 |
_ |
2 |
0 |
|||
|
Цистин (1/2 молекулы) |
0 |
1,5 |
30,0 |
2,5 |
32 |
19,9 |
3,6 |
4 |
98,9 |
_ |
0 |
|
Амидный азот |
0 |
6 |
— |
(36) |
(44) |
(79,5) |
(114,3) |
(32) |
(83,2) |
_ |
47,1 |
|
Фосфор |
(31,6) |
||||||||||
|
Молекулярный вес |
8 000 |
6 000 |
650 000 |
68000 |
69 000 |
156000 |
34 400 |
_ |
_ |
_ |
* Число аминокислотных остатков в расчете на молекулу белка.
** Число аминокислотных остатков в расчете на 100 000 г белка.
Определение числа и природы С- и N-концевых аминокислотных остатков позволило добиться существенных успехов в выяснении структуры некоторых белков. Инсулин оказался первым белком, для которого полностью установлен порядок расположения всех аминокислот [102—107]. Сангер и его сотрудники путем окисления инсулина надмуравьиной кислотой получили два основных продукта, которые оказались пептидами, содержащими цистеиновую кислоту и состоящими из 21 и соответственно 30 аминокислотных остатков. Более короткая цепь (по обозначению Сангера — пептид «А») имеет N-концевой остаток глицина и С-концевой остаток аспарагина. В более длинной цепи (пептид «В») N-концевой аминокислотой оказался фенилаланин, а на С-конце цепи находится аланин. С помощью остроумных приемов, заключающихся в широком использовании метода получения динитрофенильных производных при помощи 1-фтор-2,4-динитробензола (стр. 35) и в выделении пептидов, образующихся при кислотном и ферментативном гидролизе белка, авторам удалось полностью расшифровать порядок расположения аминокислот в пептидных цепях «А» и «В» инсулина, полученного от рогатого скота (фиг. 2).
ε-Аминогруппы лизина в молекуле инсулина свободны. В состав цепи «А» входят 2 остатка глутамина и 2 остатка аспарагина, тогда как цепь «В» содержит по одному остатку обоих амидов. Положение дисульфидных мостиков указано на фиг. 2 [107].
Интересно отметить, что строение цепи «В» в молекулах инсулина, полученного от разных видов животных (рогатый скот, свинья и овца), одинаково, тогда как цепь «А» в инсулине свиньи отличается от цепи «А», представленной на фиг. 2, наличием остатка треонина в положении 8 и остатка изолейцина в положении 10. В инсулине овцы в положении 9 вместо серина находится глицин.
В порядке расположения аминокислот в молекуле инсулина пока нельзя уловить какой-либо закономерной последовательности; этот белок, очевидно, обладает уникальным, ему одному присущим, порядком чередования аминокислот. Конечно, страшно подумать, что для каждого белка (и для каждого вида организмов) характерна своя особая последовательность аминокислот, но не исключено, что дальнейшие исследования позволят обнаружить какие-то общие закономерности, которые не могут быть выявлены на основе данных, имеющихся в настоящее время. Возможно, что изучению этой сложной области помогут физические методы исследования и рассмотрение пространственных взаимоотношений.
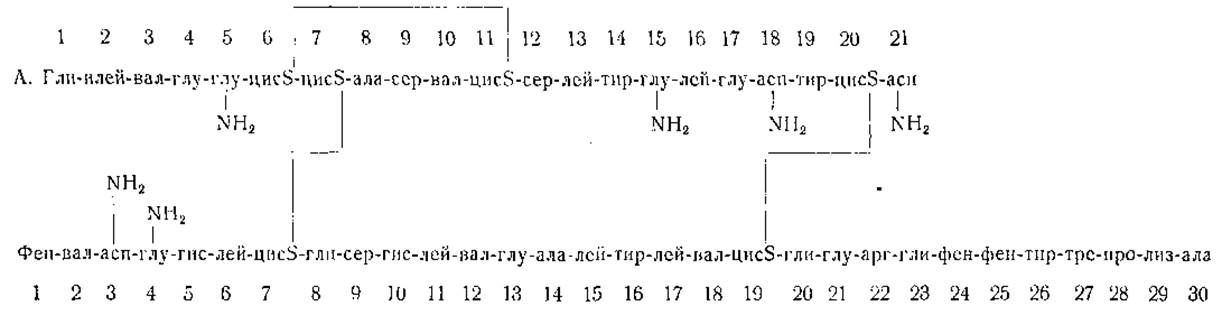
Фиг. 2. Порядок чередования аминокислот в инсулине (по Сангеру).
|
Аминокислота |
Сокращенное обозначение[573] |
Аминокислота |
Сокращенное обозначение[573] |
|
Аланин |
ала |
Изолейцин |
илей |
|
Аргинин |
арг |
Лейцин |
лей |
|
Аспарагин |
acп-NH2 |
Лизин |
лиз |
|
Аспарагиновая кислота* |
асп |
Метионин * |
мет |
|
Цистеин * |
цисSН |
Фенилаланин |
фен |
|
Цистин |
(цисS-)2 |
Пролин |
про |
|
Глутаминовая кислота |
глу |
Серин |
сер |
|
Глутамин |
глу-NH2 |
Треонин |
тре |
|
Глицин |
гли |
Триптофан * |
три |
|
Гистидин |
гис |
Тирозин |
тир |
|
4-Оксипролин* |
опро |
Валин |
вал |
* Отсутствует в инсулине.
Данные, полученные при изучении продуктов ферментативного расщепления инсулина [108], указывают на то, что для проявления биологической активности, возможно, не требуется полной сохранности молекулы инсулина. Такие исследования представляют большой интерес и могут оказаться полезными для расшифровки механизма действия инсулина.