Биохимия аминокислот - А. Майстер 1961
Природные аминокислоты
Общие свойства аминокислот
Физико-химические свойства аминокислот
Хотя детальное изложение химии аминокислот не входит в задачу этой книги, уместно рассмотреть те их свойства, которые представляют интерес с биохимической точки зрения.
Все обычные аминокислоты, входящие в состав белков, представляют собой белые кристаллические вещества, устойчивые в твердом состоянии при обычной температуре (около 25°). При нагревании до относительно высокой температуры (обычно в интервале, охватывающем несколько градусов) они разлагаются (табл. 2). Аминокислоты не имеют резких точек плавления или разложения, поэтому определение этих точек имеет ограниченную ценность для характеристики аминокислот. Как правило, аминокислоты устойчивы в водных растворах; автоклавирование таких растворов при температуре 100—200° в течение короткого времени (0,5—2 час.) не вызывает заметного разложения. Глутамин составляет исключение из этого правила; автоклавирование при нейтральном pH приводит к полной его циклизации в аммонийную соль пирролидонкарбоновой кислоты. Глутаминовая кислота также циклизуется при нагревании в водных растворах, но гораздо медленнее, чем глутамин. Устойчивость аминокислот во время гидролиза белков кислотами и щелочами обсуждалась выше (стр. 24).
1 Оптические свойства аминокислот рассмотрены на стр. 79—96.
Таблица 2 Некоторые свойства аминокислот, обычно встречающихся в белках *
|
Аминокислота |
Точка разложения, °С [109] |
Растворимость, на 100 г воды [109] |
pK'1 (СООН) [114] |
pK'(NH+3)[114] |
рK'3 [111] |
P |
|
Аланин |
297 |
16,51 (16,72 DL) |
2,34 |
9,69 |
6,0 |
|
|
Аргинин |
238 |
2,17 |
9,04 |
12,48 (гуанидин) |
10,7 |
|
|
Аспарагин |
236 |
3,11 (28°) |
2,02 |
8,80 |
5,4 |
|
|
Аспарагиновая кислота |
270 |
0,500 (0,775 DL) |
1,88 |
3,65 (СООН) |
9,60 (NH+3) |
2,7 |
|
Валин |
315 |
8,85 (7,09 DL) |
2,32 |
9,62 |
5,4 |
|
|
Гистидин |
277 |
4,29 |
1,82 |
6,00 (имидазол) |
9,17 (NH3+) |
7,1 |
|
Глицин |
290 |
24,99 |
2,34 |
9,60 |
5,9 |
|
|
Глутамин |
185 |
3,6(18°) |
2,17 |
9,13 |
5,1 |
|
|
Глутаминовая кислота |
249 |
0,843 (2,054 DL) |
2,19 |
4,25 (СООН) |
9,67 (NH3+) |
3,2 |
|
Изолейцин |
284 |
4,117(2,011 DL) |
2,36 |
9,68 |
6,0 |
|
|
Лейцин |
337 |
2,19 (1,00 DL) |
2,36 |
9,60 |
5,9 |
|
|
Лизин |
224 |
2,18 |
8,95 (a) |
10,53 (e-NHA) |
9,3 |
|
|
Метионин |
283 |
3,35 (DL) |
2,28 |
9,21 |
5,9 |
|
|
Оксипролин |
270 |
36,11 |
1,92 |
9,73 |
52 |
|
|
Пролин |
222 |
162,3 |
1,99 |
10,96 |
6,8 |
|
|
Серин |
228 |
5,023 (DL) |
2,21 |
9,15 |
5,6 |
|
|
Тирозин |
344 |
0,045 (0,351 DL) |
2,20 |
9,11 |
10,07 (ОН) |
5,6 |
|
Треонин |
253 |
20,5 (DL) |
2,71 |
9,62 |
6,8 |
|
|
Триптофан |
282 |
1,14 |
2,38 |
9,39 |
5,6 |
|
|
Цистеин |
178 |
1,96 |
8,18 |
10,28 (SH) |
5,6 |
|
|
(хлоргидрат) |
(30°) |
5,8 |
||||
|
Цистин |
261 |
0,011 [0,0326 DL (19°)] |
< 1,00 (30°) |
1,7 (СООН) |
рК3 = 7,48 (NH+3) pK4 = 9,02 (NH3+) |
4,6 |
|
Фенилаланин |
284 |
2,965 (1,29DL) |
1,83 |
9,13 |
5,4 |
* Данные относятся к L-аминокислотам (если в таблице не указана другая форма). Растворимо рК и pI измерены при 25° (если в таблице нет других указаний).
Интересно отметить, что чистый триптофан в кислом растворе относительно устойчив, тогда как триптофан, входящий в состав белка, окисляется при кислотном гидролизе последнего.
Растворимость аминокислот в воде сильно варьирует (см. табл. 2) [109]. Наименьшей растворимостью обладают цистин и тирозин, наибольшей — пролин и оксипролин. Пролин является единственной аминокислотой, хорошо растворимой в спирте (около 1,6 г в 100 мл при 20°). Растворимость большинства аминокислот в абсолютном спирте очень незначительна [110]; однако даже в этих низких концентрациях (0,0003—0,002 М) некоторые аминокислоты можно обнаружить в спиртовом растворе при помощи высокочувствительной реакции с нингидрином.
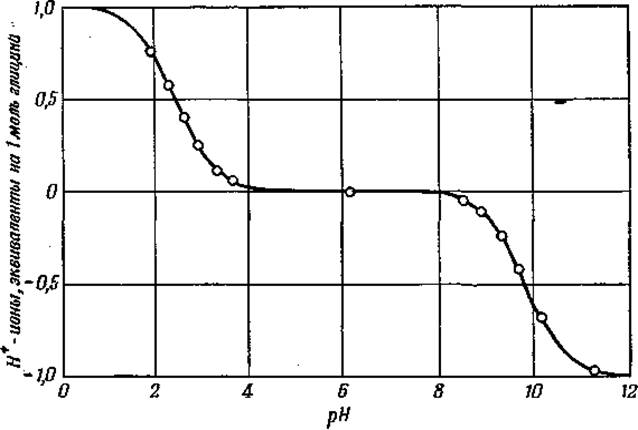
Фиг. 3. Кривая диссоциации глицина [113].
Как правило, хлоргидраты нейтральных и дихлоргидраты основных аминокислот более растворимы в воде, чем соответствующие свободные аминокислоты; большинство хлоргидратов аминокислот хорошо растворяется в спирте. Натриевые соли аминокислот (и динатриевые соли дикарбоновых аминокислот) также гораздо легче растворяются в воде и в спирте, чем свободные аминокислоты. Известно, что тирозин и цистин очень плохо растворяются в воде в интервале pH от 2,5 до 9, однако при более низких или более высоких значениях pH растворимость этих аминокислот повышается. На растворимость аминокислот в водных средах влияет присутствие солей. Некоторые аминокислоты аналогично белкам лучше растворяются при добавлении солей. Так, например, растворимость цистина увеличивается в присутствии сульфата аммония; при дальнейшем повышении ионной силы раствора цистин «высаливается» из раствора [111]. Более подробно вопрос о растворимости аминокислот рассматривается в обзорах Эдсолла и Скетчерда [112], а также Кона и Эдсолла [110].
В водных растворах аминокислоты находятся в виде диполярных ионов (цвиттерионов); например, молекула глицина может быть представлена следующим образом:
![]()
Согласно Брёнстеду, кислотой называется соединение, способное отдавать протон, а основанием — вещество, которое может присоединять протон. Кривая титрования глицина соляной кислотой и натронной щелочью имеет 2 точки перегиба (фиг. 3) [113]. Таким образом глицин может реагировать и как кислота и как основание, иначе говоря, он является амфолитом:
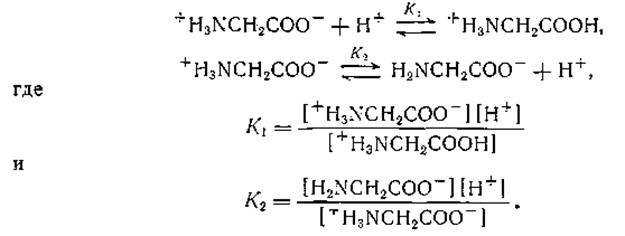
Для глицина рК'1 = 2,34 и рК'2 = 9,60 (обычно принято указывать величины рК' аминокислот в порядке уменьшения кислотности). Так как рК' для уксусной кислоты равно 4,8, то ясно, что наличие NH+3-группы в молекуле глицина повышает кислотность карбоксильной группы глицина. Последнее обстоятельство можно объяснить тем, что NH+3-группа способствует отталкиванию иона водорода от карбоксильной группы. Ацилирование аминогруппы глицина уменьшает степень диссоциации карбоксильной группы; так, величины pK'1 для ацетилглицина и хлорацетилглицина равны 3,60 и 3,37 соответственно. У глицинамида рК'2 = 7,93, тогда как у глицина рК'2 = 9,60.
Диссоциационные кривые тех аминокислот, молекулы которых содержат более двух диссоциирующих групп, имеют дополнительные точки перегиба. Так, величины рК' для гистидина составляют 1,82 (карбоксил), 6,00 (имидазол) и 9,17 (NH+3).
Изоэлектрической точкой (pI) аминокислоты считается то значение pH, при котором молекула аминокислоты электронейтральна; при этом pH не происходит передвижения аминокислоты в электрическом поле. Величина pI для глицина равна 5,97; однако из его титрационной кривой (см. фиг. 3) видно, что глицин находится в изоэлектрическом состоянии в довольно широком интервале pH. Изоэлектрическую точку для монокарбоновой аминокислоты можно найти путем деления суммы pK'1 и рК'2 на 2. Для аминокислот с тремя диссоциирующими группами pI с достаточной точностью может быть определена как среднее из двух преобладающих величин рК'. Величины рК' для диссоциации гуанидиновой группы аргинина, фенольной группы тирозина и сульфгидрильной группы цистеина составляют соответственно 12,48, 10,07 и 10,78. Для более детального ознакомления с этим вопросом читателя можно отослать к обзору Эдсолла [114]. Величины рК' для аминокислот, обычно встречающихся в белках, приведены в табл. 2.