Биохимия - Химические реакции в живой клетке Том 1 - Д. Мецлер 1980
Энергетика биохимических реакций
Таблицы значений ∆G0 для биохимических соединений
Свободная энергия образования
В табл. 3-3 в первой колонке приведены значения ![]() — стандартной свободной энергии образования из элементов целого ряда чистых твердых, жидких и газообразных веществ, а также аналогичные значения для соединений в растворе при гипотетической моляльной активности. Остановимся несколько подробнее на последнем случае.
— стандартной свободной энергии образования из элементов целого ряда чистых твердых, жидких и газообразных веществ, а также аналогичные значения для соединений в растворе при гипотетической моляльной активности. Остановимся несколько подробнее на последнем случае.
Значение ∆Gf0 для чистой уксусной кислоты, находящейся в жидком состоянии, равно —389,1 кДж∙моль-1. Уравнение реакции образования этого соединения из элементов имеет вид
![]()
Чтобы получить свободную энергию образования в водном растворе, мы должны знать растворимость и коэффициент активности уксусной кислоты при разных концентрациях. Из этих данных нужно рассчитать изменение свободной энергии в процессе растворения жидкой уксусной кислоты в воде, так чтобы получился гипотетический моляляльный водный раствор уксусной кислоты в стандартном состоянии:
![]()
Из уравнений (3-38) и (3-39) получаем
![]()
Во многих расчетах удобно иметь значения ∆G для ионов одного сорта, например для ацетата. Значение ∆G0f ацетата- (води) можно
Таблица 3-3 Свободные энергии образования я окисления при 25°С ряда соединенийa,б
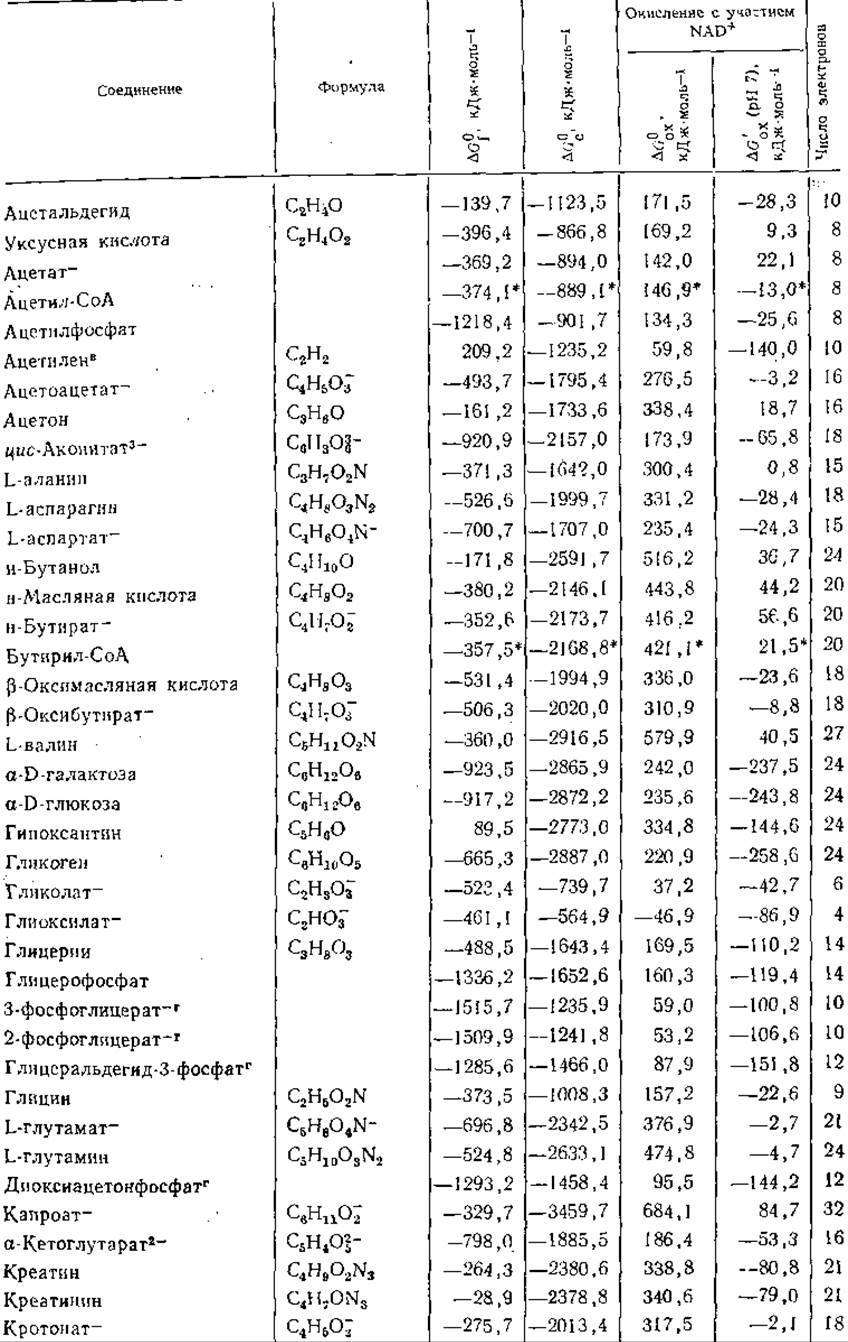


а Приведенные в таблице величины представляют собой ∆G0f — стандартные свободные энергии образования соединений из элементов; ∆G0c — стандартные свободные энергии сгорания; ∆G0ox — стандартные свободные энергии окисления под действием NAD+ с образованием NADH+H+, СO2, Н2O, N2, HPO2-4 и SO3-; ∆G'ox (pH7) — кажущиеся изменения свободной энергии при pH7. Все величины выражены в кДж∙моль-1 и, если специально не оговорено, относятся к водному раствору при 25 °С. Символ (г) означает, что вещество находится в газообразном состоянии при давлении 1 атм. В последней колонке указано число электронов, участвующих в полном окислении вещества до СO2, Н2O, N2и H2SO4. Если оно отрицательно, это означает, что для получения указанных продуктов вещество должно быть восстановлено (например, 2NO-3 + 10e- + 12Н+—>N2+6H2O). Данные для фосфорных эфиров относятся к соединениям с полностью диссоциированными фосфатными группами (—О—РО2-3). Значения ∆G0f для многих из этих соединений рассчитывались по формуле: ∆G0f(нефосфорилнрованного соединения) — ∆G0гидролиза (до НРО2-4, табл. 3-5) —∆G0f(на молекулу фосфорного эфира образуется одна молекула воды)+G0fНРО2-4 (берется из данной таблицы). Данные Бассхэма и Краузе использованы в таблице без изменений. Для производных ацил-СоА группа СоА(—SH) рассматривается как «элемент»;
в этом случае значение ∆G0fотмечено звездочкой и относится к образованию соединения из соответствующих элементов и свободного СоА; при этом значения ∆G0cи ∆Goxсоответствуют окислению с образованием обычных продуктов плюс СоА. Значения ∆G0f для каждого из этих соединений рассчитаны из ∆G0fсоответствующего спирта или карбоксилат-аниона с использованием значений ∆G0fгидролиза (табл. 3-5). Еще одна весьма полная таблица значений свободной энергии приведена в издании. Biochemical Microcalorimetry (Brown Н. D., ed.), pp. 305—317, Academic Press, New York. 1969.
б Основной источник данных: Long C., ed., Biochemists Handbook, pp. 90—92. Van Nostrand, Reinhold, Princeton, New Jersey, 1961. Многие данные взяты из работы Burton K., Ergeh. Physiol., Biol. Chem. Exp. Pharmakol., 49, 275—298, 1957.
в Stull D. R., Westrum E. F., Jr., Sinke G. C., The Chemical Thermodynamics of Organic Compounds, Wiley, New York, 1969.
r Bassham J. A., Krause G. H., BBA, 189, 207—221, 1969.
д Van Wazer J. R., Phosphorus and Its Compounds, Vol. I, p. 889, Wiley (Inter- science), New York, 1958.
получить из ∆G0f уксусной кислоты(водн), привлекая ∆G0диссоциации:
![]()
Свободная энергия образования ионов Н+ принята равной нулю. Суммируя уравнения (3-40) и (3-41), получаем ∆G0fацетата- = -369,2 кДж∙моль-1.