Биохимия - Химические реакции в живой клетке Том 1 - Д. Мецлер 1980
Энергетика биохимических реакций
Таблицы значений ∆G0 для биохимических соединений
Роль ионов металлов
И АТР, и ADP, и неорганический пирофосфат образуют комплексы с ионами металлов. В физиологических условиях преобладают комплексы ADP и АТР с ионами магния; рассмотрим уравнения соответствующих реакций и изменения свободной энергии и энтальпии [12] (приведены кажущиеся значения для 25 °С и μ = 0,2, выраженные в кДж∙моль-1).
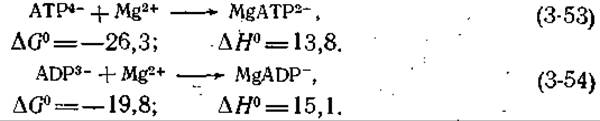
Используя кажущиеся значения ∆G0 из уравнений (3-53) и (3-47), получаем
![]()
Стехиометрия уравнения (3-55) никогда в точности не выполняется; какое-то количество Mg2+ уходит в раствор в результате диссоциации MgADP-; как протоны, так и ионы Mg2+ связываются с H2РО-4; в среде присутствуют также НАТР3- и HADP2-, слабо связывающие Mg2+ [13]. Таким образом, наблюдаемые значения ∆Gobs меняются с изменением как pH, так и концентрации магния, а также зависят от ионной силы. Олберти [13] и Филлипс и др. [14] составили таблицы и графики кажущихся значений ∆Gobs для различных условий. На рис. 3-2 представлен один из графиков, построенный исходя из констант и уравнений Олберти1. Определяемое из этого графика ∆Gobs для гидролиза АТР при pH 7, 25°С, μ = 0,2 и 1 мМ Mg2+ (сравнительно высокая концентрация [15]) равно —30,35 кДж∙моль-1 (—7,25 ккал∙моль-1).
Мы видим, что образование комплекса с Mg2+ немного снижает потенциал переноса фосфорильной группы АТР. Существенное влияние может оказывать ’непостоянство концентрации Mg2+ во времени, а также неоднородность концентрации внутри клетки [16]. В тканях магний является главным, однако далеко не единственным катионом. На равновесие полифосфатов (например, АТР) заметное влияние оказывают Са2+, Мn2+ и даже К+.
1 Однако значение ∆G' гидролиза АТР = 35,54 кДж∙моль-1 при [Mg2+] = 0 получено по данным работы [11]. Значения рKа и константы образования комплексов с Mg2+ взяты у Олберти [13]. Интересно отметить, что Джордж и, др. [15] определяли для этих же комплексов константы образования при бесконечном разбавлении и получили гораздо более отрицательные значения ∆G0f, чем приведенные в уравнениях (3-53) —(3-55).
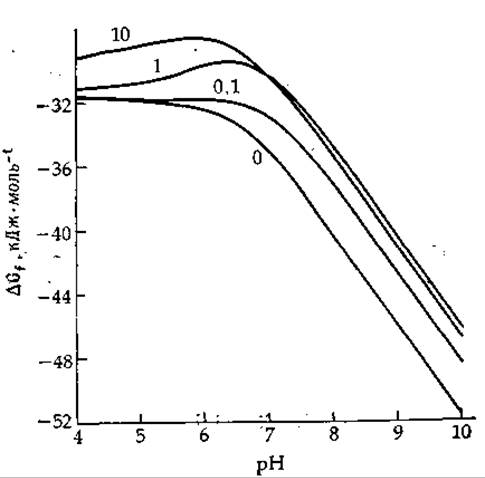
РИС. 3-2. pH-зависимость кажущейся свободной энергии ∆Gobsгидролиза АТР при различных концентрациях свободных ионов магния (числа у кривых — концентрация Mg2+в мМ). Кривые построены с помощью ЭВМ и приводятся с любезного разрешения Carol. М. Harris.