Биохимия - Химические реакции в живой клетке Том 1 - Д. Мецлер 1980
Как молекулы соединяются друг с другом
Силы, действующие между молекулами
Притяжение между заряженными группами (электростатические силы)
Фиксированные положительные и отрицательные заряды сильно притягиваются друг к другу. Рассмотрим в качестве примера взаимодействие карбоксилат-иона с ионом —NH3или с Са2+:
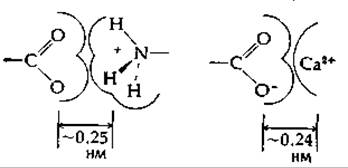
Исходя из значений вандерваальсовых радиусов (табл. 2-1) и радиуса иона Са2+ в кристалле (0,10 нм), можно оценить расстояние между центрами положительного и отрицательного зарядов; оно составляет в обоих случаях 0,25 нм. (Если, однако, заряженные группы окружены гидратными оболочками из ориентированных молекул воды, расстояние между центрами может быть значительно больше.) Вычислим, исходя из закона Кулона, силу притяжения F между двумя заряженными частицами, почти соприкасающимися друг с другом (находящимися, например, на расстоянии 0,30 нм):
![]()
Здесь r — расстояние в метрах, q и q' — заряды в кулонах (элементарный заряд, т. е. заряд одного электрона = 1,6021∙10-19 кулонов); ε — диэлектрическая постоянная; F — сила в ньютонах. В расчете на один моль вещества эта сила равна NF, где N — число Авогадро.
Весьма неопределенной величиной здесь является диэлектрическая постоянная є, которая для вакуума равна 1,0, для углеводородов ~2,0, а для воды при 25 °С — 78,5. Если принять є равной 2, то сила притяжения на расстоянии r = 0,30 нм составит 7,7∙1014 Н∙моль-1 (для Са2+ и СОО- она будет вдвое больше). Это означает, что увеличение расстояния между зарядами на 0,01 нм требует затраты значительного количества энергии, а именно 7,7 кДж∙моль-1. В случае воды, для которой диэлектрическая проницаемость велика, эта величина будет почти в 40 раз меньше, и сила электростатического притяжения перестанет играть столь существенную роль.
Часто бывает необходимо определить работу, которую нужно совершить, чтобы разнести на бесконечно большое расстояние два заряда, находящиеся на данном расстоянии друг от друга (например, на расстоянии 0,30 нм). Эта работа равна
![]()
Если ε = 2, то для элементарных зарядов, находящихся на расстоянии 0,30 нм друг от друга, W = 232 кДж∙моль-1; при r = 1 нм W = 69 кДж∙моль-1, а при r =10 нм (т. е. на расстоянии, соответствующем толщине клеточной мембраны) работа составляет всего лишь 6,9 кДж∙моль-1. Результаты этих расчетов потребуются нам дальше, а сейчас достаточно заметить, что между близко расположенными зарядами действуют огромные силы.
Электростатические силы играют очень важную роль во взаимодействиях между молекулами и часто являются причиной изменения их конформации; например, притяжение между группами —СОО- и —NH3 весьма существенно для взаимодействий между молекулами белка. С карбоксильными группами белков и углеводов в растворе часто взаимодействуют ионы кальция, что иногда приводит к переходу растворов этих веществ в гелеобразное состояние (примером может служить агароза, гл. 2, разд. В.5). Катион Са2+, обладающий двойным зарядом, может играть роль «мостика», соединяющего две карбоксильные или иные полярные группы.
Важным аспектом всех электростатических взаимодействий в водных растворах является гидратация ионов. Каждый ион в воде окружен оболочкой ориентированных определенным образом молекул воды, образующейся за счет притяжения диполей воды к заряженному иону. Гидратация ионов оказывает сильное влияние на электростатическое взаимодействие всех ионов в растворе и во многом определяет такие параметры, как сила кислот и оснований, свободная энергия гидролиза АТР, прочность связи иона металла с отрицательно заряженными группами.
Количественно оценить влияние гидратации очень сложно. Заметим, например, что ∆G0 диссоциации уксусной кислоты составляет 27,2 кДж∙моль-1 (табл. 3-4), а это значительно меньше работы по разделению двух зарядов в среде с ε = 2, которая по расчетам составляет 232 кДж ∙ моль-1. Значение ∆Н0 для процесса диссоциации уксусной кислоты близко к 0 (—0,1 кДж ∙ моль-1), a ∆S, следовательно, равно —91,6 Дж ∙ К-1. Столь сильное уменьшение энтропии свидетельствует об увеличении числа молекул воды, образующих гидратные оболочки протонов и ацетат-ионов — продуктов диссоциации. В отличие от этого (табл. 3-4) диссоциация иона NH+4 на NH3 и Н+, в результате которой вместо одного положительно заряженного иона образуется другой, характеризуется величиной ∆Н0, равной +52,5 кДж∙моль-1, и сравнительно небольшим изменением энтропии: ∆S0 = —2,0 Дж∙К-1.