Биохимия - Химические реакции в живой клетке Том 1 - Д. Мецлер 1980
Как молекулы соединяются друг с другом
Мышцы
Структурная организация поперечнополосатой мышцы
Среди большого числа сложных структур, построенных из белковых субъединиц, ни одна не привлекла к себе большего внимания, чем способные к сокращению мышечные волокна. В организме человека существует несколько типов мышц. Поперечнополосатые скелетные мышцы действуют под произвольным контролем. Близка к ним по структуре сердечная мышца с характерной поперечной исчерченностью; она контролируется непроизвольно. К третьему типу относятся непроизвольные гладкие мышцы. У других видов встречаются мышцы особого типа. Так, например, асинхронные летательные мышцы некоторых насекомых позволяют им махать крыльями с частотой ~100—1000 взмахов в секунду. В этих мышцах нервные импульсы используются только для того, чтобы «запускать» и останавливать движение крыльев; что же касается цикла сокращение — релаксация, то он осуществляется автоматически.
Поперечнополосатые мышцы состоят из пучков длинных нитей (волокон) диаметром 10—100 мкм, которые образуются обычно в результате слияния большого числа эмбриональных клеток. Длина таких волокон у млекопитающих составляет, как правило, 2—3 см, однако иногда достигает 50 см. Каждое волокно можно рассматривать как клетку, содержащую до 100—200 ядер. В клетках присутствуют обычные клеточные органеллы, имеющие, однако, специальные названия. Например, плазматическая мембрана (плазмалемма) мышечных клеток (волокон) носит название сарколеммы; их цитоплазма называется саркоплазмой, а митохондрии — саркосомами.
Наиболее характерной особенностью мышечных клеток является наличие в них сократительных миофибрилл, представляющих собой специальным образом организованные пучки белковых молекул.
В световом микроскопе в миофибриллах видны поперечные линии, отстоящие друг от друга на расстоянии примерно 2,5 мкм (рис. 4-21 и 4-22). Область между двумя плотными Z-пластинками, называемая саркомером, является главным сократительным элементом мышечной клетки. В центре саркомера имеется плотная анизотропная полоса (обладающая сильным двойным лучепреломлением), получившая название A-диска. Продолжением Z-пластинок являются менее интенсивные 1-диски. Их название происходит от английского слова isotropic и не является удачным, поскольку, хотя 1-диски и не обладают двойным лучепреломлением, они не являются изотропными. Слабо окрашенные М-линии, которые можно наблюдать только при помощи электронного микроскопа, расположены в центре A-дисков и саркомеров.
Детальная структура саркомера оставалась неясной до 1953 г., когда Г. Хаксли, исследуя тонкие срезы мышц под электронным микроскопом, обнаружил, что белковые нити расположены строго упорядоченным образом [83]. Оказалось, что толстые нити диаметром 12—16 нм и длиной ~1,5 мкм уложены в форме шестиугольника диаметром 40—50 нм и проходят через весь A-диск (рис. 4-21,5). Между этими толстыми нитями проходят тонкие нити диаметром 8 нм, простираясь от Z-пластинки на расстояние ~1,0 мкм. Исследование мышцы в состоянии сокращения показало, что 1-диски в ней почти исчезают, а область перекрывания толстых и тонких нитей увеличивается; это означает, что в процессе сокращения тонкие и толстые нити скользят друг относительно друга. В скелетной мышце саркомер укорачивается до — 1,7—1,8 мкм; в летательной мышце насекомых это укорочение не столь велико, однако процесс сокращения многократно повторяется с очень высокой частотой.
Миофибриллярные белки составляют 50—60% общего количества белков мышечных клеток. При низкой ионной силе эти белки нерастворимы, а при повышении ее до ~0,3 становятся растворимыми и могут быть экстрагированы. Главный белок мышцы миозин составляет основу толстых нитей. Другой белок, актин, является главной составной частью тонких нитей (рис. 4-7). С нитями актина связаны «регуляторные белки» мышцы — тропомиозин и тропонин [84], а в Z-пластинке имеется а-актин. Не так давно в составе М-линий обнаружен белок, который был назван М-белком [85].
Молекулы миозина имеют форму очень длинных тонких нитей размером ~ 160x2 нм (рис. 4-23). Большая часть молекулы состоит из двух, вероятно идентичных полипептидных цепей, находящихся в форме а-спиралей [86]. Эти цепи закручены одна относительно другой (гл. 2, разд. Б.З.г). С-концевой участок молекулы по форме напоминает палочку; со стороны N-конца с обеими тяжелыми цепями связаны четыре субъединицы с мол. весом ~16 000—21 000, образующие пару «головок». Кратковременная обработка трипсином расщепляет молекулу миозина на два фрагмента. Из хвостового участка образуется легкий меромиозин (ЛММ) — фрагмент длиной 90 нм, а из остальной части, включающей «головки», — тяжелый меромиозин (ТММ). Тяжелый меромиозин можно расщепить далее путем более длительной обработки трипсином, в результате чего получается один 52-фрагмент длиной 40 нм с мол. весом ~ 62 000 и два идентичных S1 -фрагмента с мол. весом ~110 000, представляющих собой «головки» (рис. 4-23).

РИС. 4-21. А. Схематическое изображение структуры типичного саркомера скелетной мышцы. Приведенный продольный разрез соответствует электронно-микроскопической фотографии рис. 4-22. Б. Схема, иллюстрирующая расположение толстых и тонких нитей в поперечнополосатой мышце (поперечное сечение). В. Слева: электронно-микроскопическая фотография поперечного среза мышцы кролика, обработанной глицерином. В центре кружка можно видеть, что шесть тонких нитей расположены по вершинам шестиугольника вокруг толстой нити. Остальные шесть толстых нитей расположены в вершинах шестиугольника большего размера. Справа: поперечный срез гладкого мышечного волокна. Толстые и тонкие нити расположены неупорядоченно. Видны нити промежуточной толщины, образующие скопления в виде «плотных телец» (1), наличие которых является характерной особенностью гладких мышц.

РИС. 4-22. А Электронно-микроскопическая фотография продольного среза скелетной мышцы млекопитающего (двуглавой мышцы свиньи) Ткань фиксирована дважды — сначала формальдегидом и глутаральдегидом, а затем тетраокисью осмия. Далее обработана уранилацетатом и цитратом свинца. На фотографии видно волокно белой мышцы, содержащее несколько митохондрий, н тонкие Z-пластинки. Видны М-линия, А- и I диски, а также толстые и тонкие нити. Обратите внимание на периодичность (~ 40 нм) вдоль тонких нитей. Это расстояние соответствует длине молекулы тропомиозина, а поперечная исчерченность обусловлена, по-видимому, связываниемтропомиозина и тропонина. Множество плотных частиц в верхней части фотографии — это гранулы гликогена, а горизонтальные мембраноподобные структуры — поперечные трубочки саркоплазматического (эндоплазматического) ретикулума Они расположены вблизи трубочек, идущих от поверхности мышечного волокна В верхнем левом углу фотографии по обе стороны от Z-пластинки видны продольные срезы Т-трубочек, а в верхнем правом углу — поперечные срезы Видно, что Т-трубочка лежит между двумя боковыми цистернами саркоплазматического ретикулума.

РИС. 4-22 Б. Продольный срез гладкой мышцы (мускульного желудка цыпленка); препарат фиксирован так, как это указано в подписи под рис. 4-22, А. Видны толстые нити (1), которые значительно толще толстых нитей поперечнополосатой мышцы и расположены менее упорядоченно. Они окружены большим числом тонких нитей, часто связанных с «плотными тельцами» (2). В центре фотографии видна митохондрия (3), а внизу проходит граница раздела между двумя соседними клетками. Обратите внимание на пиноцитозные пузырьки, содержащиеся в больших количествах в плазматических мембранах и высокоактивные в гладких мышцах. (С любезного разрешения Marvin Stromer, Iowa State University.)
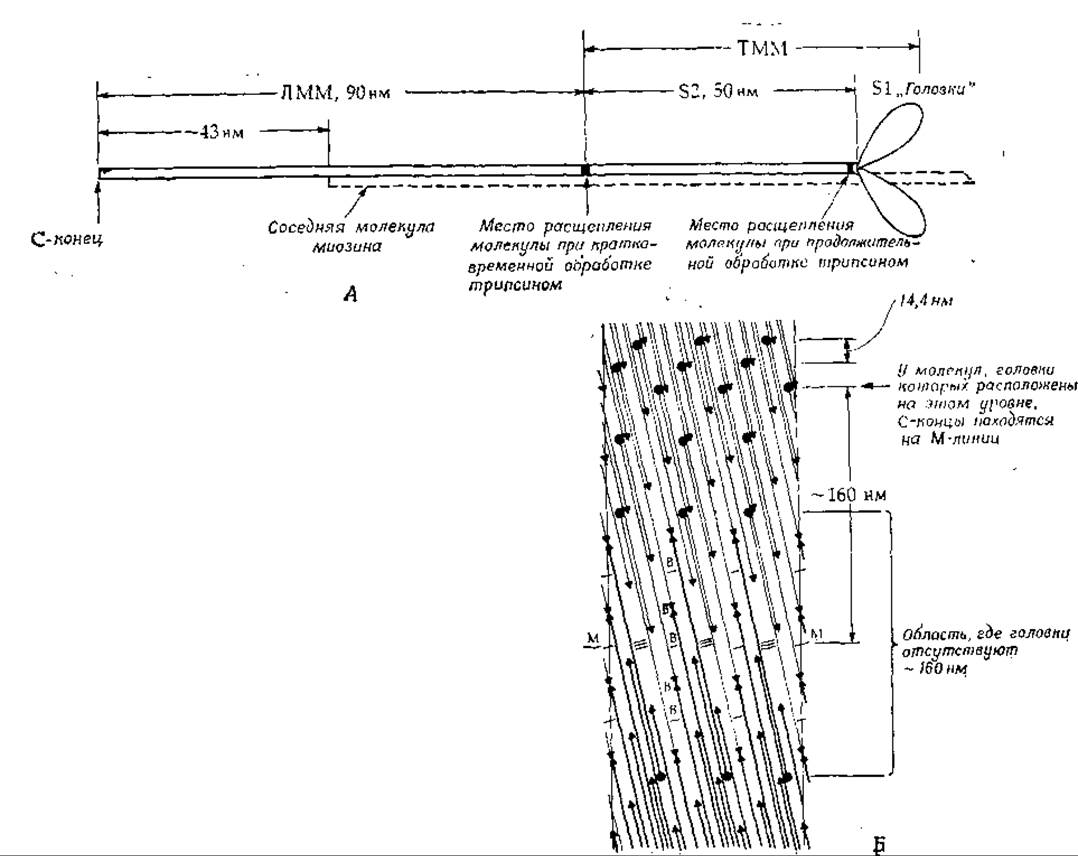
РИС. 4-23. А. Схема молекулы миозина. На расстоянии 90 нм от С-конца расположен участок, по которому расщепляется молекула при кратковременной обработке трипсином. В результате расщепления образуются два фрагмента — легкий и тяжелый меромиозины (ЛММ и ТММ). Общая длина молекулы миозина ~ 160 нм, мол. вес — 470 000; молекула состоит из двух тяжелых цепей (мол. вес 200 000) и двух пар легких цепей головок (мол. вес 16 000—21 000), размером ~ 15X4X3 нм. Б. Предложенная Сквайром [87] схема строения толстых нитей скелетной мышцы Позвоночных. Показана лишенная головок (оголенная) область вблизи М-линии. Темными кружками обозначены головки на концах миозиновых молекул (палочек), а темными треугольниками — противоположные концы миозиновых палочек. Взаимодействие между антипараллельно расположенными молекулами на протяжении 43 и 130 нм отмечено соответственно одинарной и тройной поперечными линиями. Встречными стрелочками (треугольниками) обозначены места соединения миозиновых молекул (палочек) «хвост к хвосту». Молекулы простираются от середины структуры, где расположены их С-концы, к поверхности нитей, где находятся их головки. На уровнях, обозначенных буквой В, к миозиновой нити присоединяется М-мостик. Уровень М—М — это центр М-линии и всей нити.
Растворенные молекулы миозина могут агрегировать, образуя палочки, аналогичные толстым мышечным нитям. Поскольку диаметр таких нитей составляет ~ 14 нм, в них должно быть упаковано большое число молекул миозина (их диаметр 2 нм). Электронно-микроскопические исследования показали, что из толстых нитей выступают головки, интервал между которыми ~43 нм. Однако в области М-линии головки отсутствуют; это дает основание думать, что агрегация мономеров миозина происходит здесь по принципу «хвост к хвосту». Предполагается, что в миозиновых нитях скелетной мышцы [87] плотно упакованы 300 молекул миозина (до 30 палочек в поперечном сечении нити); в центре имеется небольшая полость (рис. 4-23). На самом деле структура может быть несколько иной — на каждый повторяющийся участок спирали длиной 14,3 нм может приходиться 3 (а не 4) головки [88]. В миозиновых нитях содержится также в небольших количествах другой белок, С-белок [88]. В летательных мышцах насекомых способ упаковки миозиновых палочек иной.
Белок актин обладает специфическими, только ему присущими свойствами. Нативный фибриллярный F-актин (рис. 4-7) построен из мономерных субъединиц с мол. весом ~ 43 000, каждая из которых состоит из 374 аминокислотных остатков. Интересно, что в молекулах актина в положении 73 содержится остаток Nт-метилгистидина. В среде с низкой ионной силой в присутствии АТР нити актина могут растворяться, образуя мономерный G-актин. Каждая молекула G-актина содержит обычно одну молекулу связанного АТР и ион кальция. Добавление в раствор Mg2+ до концентрации 1 мМ или КСl (0,1 М) приводит к спонтанному образованию нитей, сходных с тонкими нитями мышцы, каждая из которых содержит 340—380 мономерных молекул актина. АТР при этом гидролизуется, a ADP остается связанным с нитями F-актина. Поражает удивительное сходство этого процесса со связыванием нуклеотидов с субъединицами микротрубочек (дополнение 4-А) и событиями, происходящими при сокращении отростка фага (дополнение 4-Д).
Тот факт, что комплекс актина и миозина ответствен за сокращение мышцы, был известен задолго до выяснения тонкой структуры миоибрилл. Уже примерно в 1929 г. было установлено, что источником энергии при мышечном сокращении является АТР, однако только спустя 10 лет Энгельгардт и Любимова показали, что выделенные из мышцы препараты миозина катализируют гидролиз АТР [88а], доказав тем самым, что энзиматические механизмы, обеспечивающие использование свободной энергии, которая высвобождается при гидролизе АТР, связаны с основными белками, образующими мышечные волокна. Позднее А. Сент-Дьерди [88 b, с] показал, что для стимулируемого ионами Mg2+ гидролиза АТР (АТРазная активность) необходим комплекс двух белков — актина1 и миозина (актомиозин). Он обнаружил также явление суперпреципитации, заключающееся в быстром сокращении актомиозина в пробирке при добавлении АТР. Хотя вопрос о том, имеет ли отношение суперпреципитация к мышечному сокращению, до сих пор неясен, тем не менее открытие этого явления сыграло в свое время важную роль, поскольку оно привлекло внимание ученых к кооперативному взаимодействию актина и миозина в процессе функционирования мышцы.
1 Актин был открыт Ф. Штраубом [88d].
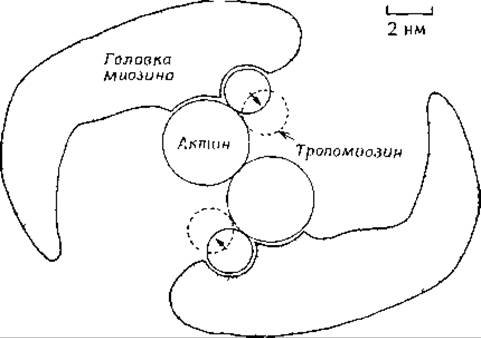
РИС. 4-24. Гипотетическая структура комплекса актомиозин — тропомиозин (если смотреть на него сверху вниз, вдоль оси актиновой нити) [92, 94]. Взаимодействие актина с головкой миозина S1 и АТР блокируется тропомиозином (сплошные кружки). Предполагается, что в присутствии Са2+ тропомиозин перемещается в положения, указанные пунктирными кружками, и блокировка снимается [93, 94].
Химические исследования миозина показали, что индуцируемая актином АТРазная активность локализована в его «головках». На электронно-микроскопических фотографиях нередко видно, что головки миозина соединены с расположенными поблизости актиновыми нитями, образуя поперечные мостики. Когда скелетная мышца находится в релаксированном состоянии (не активирована нервным импульсом), поперечные мостики разомкнуты (в этом состоянии мышца способна свободно растягиваться). Когда же мышца активирована и находится в напряжении, то на фотографиях часто видны поперечные мостики. После истощения запаса АТР (т. е. после энергетической смерти) мышца переходит в состояние окоченения. Почти все поперечные мостики присоединены при этом к тонким актиновым нитям, следствием чего и является полная неподвижность мышцы. Из этих данных следовало, что в процессе сокращения головки миозиновых нитей присоединяются к тонким актиновым нитям. Затем гидролиз АТР сопрягается неизвестным пока образом с генерацией натяжения. Далее головки освобождаются и присоединяются к новым местам. Повторение этого процесса приводит к скольжению нитей друг относительно друга. Химические механизмы, лежащие в основе этих событий, еще мало изучены [89, 90]. Все, что о них известно, изложено в дополнении 10-Е.
Механизмы, обеспечивающие регуляцию произвольного сокращения мышц, не менее удивительны, чем сам процесс сокращения. Эндоплазматический (саркоплазматический) ретикулум в клетках мышц характеризуется высокой степенью упорядоченности [91, 92]. Соединительные трубочки проходят вдоль нитей, располагаясь среди пучков сократительных элементов, и через строго определенные интервалы тесно контактируют со складками наружной клеточной мембраны (Т-система мембран, рис. 4-22,А). Нервный импульс попадает в мышечное волокно, проходящее вдоль плазмалеммы, и достигает Т-трубочек. В областях тесно 10 контакта сигнал каким-то образом передается соединительным трубочкам саркоплазматического ретикулума, содержащим ионы кальция в высокой концентрации, и вызывает проникновение этих ионов в цитоплазму и в миофибриллы. Здесь кальций связывается с С-субъединицей тропонина, олигомерного белка, который вместе с тропомиозином (гл. 2, разд. Б.З.г) образует регуляторный комплекс. Именно этот комплекс присоединяется к фибриллам актина (рис. 4-24).
Если полностью удалить регуляторные белки из актиновых фибрилл, то сокращение будет продолжаться до тех пор, пока не истощится запас АТР. В присутствии же регуляторных белков и в отсутствие кальция блокируется как сокращение, так и гидролиз АТР. Рабочая гипотеза, объясняющая функционирование этой системы [93, 94], постулирует, что вытянутые палочки тропомиозина входят в бороздки между актином и миозиновыми головками [92]. На рис. 4-24 схематически представлена структура комплекса актомиозин-тропомиозин (вид сверху). Головка (S1) молекулы миозина присоединена к одной из субъединиц актина. В покоящейся мышце тропомиозин присоединен к актину около того места, с которым связан S1-участок миозина. В результате палочка тропомиозина блокирует присоединение S1-поперечных мостиков миозина к актину и предотвращает стимулируемый актином гидролиз АТР. Молекула тропомиозина, длина которой составляет ∼41 нм, контактирует одновременно с семью субъединицами актина [95]. Таким образом, комплекс тропомиозин — тропонин синхронно контролирует работу семи субъединиц актина.
Молекула тропонина состоит из трех полипептидных цепей с мол. массами от 18 000 до 37 000 дальтон. Один полипептид (Т) прочно связывает тропонин с тропомиозином в участке, расположенном приблизительно на одной трети расстояния от С- до N-конца, со стороны С-конца. Второй полипептид (I), входящий в состав тропонина, взаимодействует с актином в отсутствие ионов Са2+ и «работает» вместе с остальными двумя полипептидами, удерживая тропомиозин в таком положении, в котором он ингибирует гидролиз АТР. Когда третий полипептид (С-субъединица) присоединяет ионы кальция, то ингибирование прекращается и может начаться сокращение. Однако общая картина функционирования всей этой «машины» остается непонятной. По данным рентгеноструктурного анализа и электронной микроскопии [93, 94], при связывании кальция с тропонином тропомиозин отклоняется от S1 примерно на 20°, открывая активный центр для взаимодействия миозин — АТР—актин (рис. 4-24). Возможно, тропомиозин «катится» наподобие ролика вдоль поверхности актина, открывая центры одновременно в семи молекулах актина? Если это действительно так, то какого рода «мотор» используется при этом и что не позволяет ролику «упасть» с актина? Обо всем этом мы может только догадываться. Вполне возможно, что боковые цепи отдельных аминокислотных остатков тропомиозина, выступающие наподобие зубцов на субмикроскопической шестеренке, входят в комплементарные углубления актина1. Тогда возникает вопрос: почему связывание иона кальция с тропомиозином приводит к тому, что тропомиозин начинает «катиться», как ролик, по актину? Мы знаем, что присоединение металлов к белкам может приводить к очень сильным конформационным изменениям (разд. В.8.в). Не исключено, что конформационное изменение С-субъединицы тропонина может каким-то образом трансформироваться в энергию, необходимую для такого движения.
1 Было высказано предположение о существовании серии мостиков из ионов магния между отрицательно заряженными участками тропомиозина и актина [95а].