Биохимия - Химические реакции в живой клетке Том 1 - Д. Мецлер 1980
Молекулы, из которых мы состоим
Принципы построения малых молекул
Таутомерия
Многие простые органические соединения существуют в виде смеси двух и более изомеров, или таутомерных форм, быстро переходящих одна в другую. Таутомеры, по крайней мере в принципе, можно разделить при низких температурах, когда переход из одной формы в другую затруднен.
Классическим примером явления такого рода служит кето-енольное равновесие
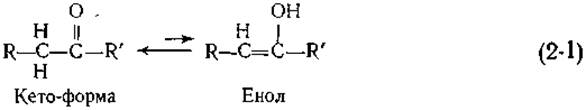
Хотя енол обычно менее устойчив, чем кето-форма, он все-таки всегда присутствует в системе, хотя и в малых количествах. Енол легко образуется из кето-таутомера благодаря тому, что атомы водорода при углероде, связанном с карбонильной группой (С = О), имеют отчетливо выраженные кислотные свойства. Одним из основных факторов, порождающих таутомерию, является наличие легко диссоциирующего протона. Однако обычно атомы водорода, связанные с атомами углерода, слабо диссоциируют, и поэтому таутомерия возникает лишь в присутствии карбонильной или какой-либо другой «активирующей группы».
Как правило, легко диссоциируют протоны, связанные с атомами кислорода или азота, предопределяя возможность таутомерии в амидах и кольцевых системах, содержащих атомы О и N [уравнения (2-2) -(2-5)].
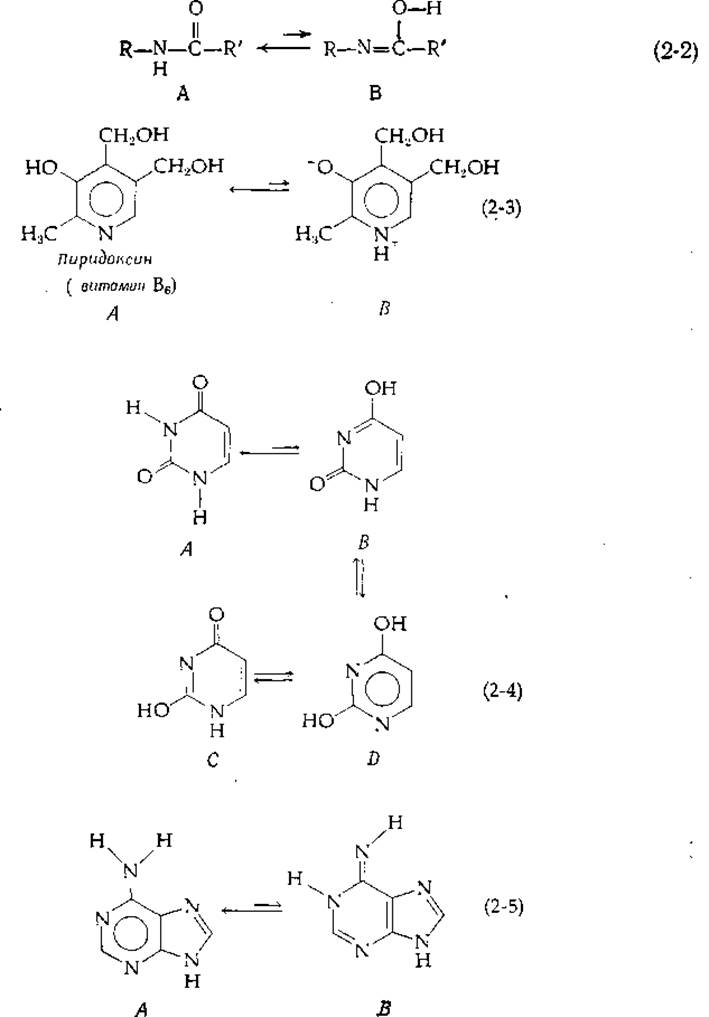
Таутомерия, описываемая уравнением (2-2), близка к кето-енольному превращению. Форма В изредка присутствует в пептидах. Пиридоксин [уравнение (2-3)] в водном растворе находится преимущественно в форме биполярного ионного таутомера В, но в метаноле принимает форму незаряженного таутомера А. Пиримидины [уравнение (2-4)] и пурины [уравнение (2-5)] способны образовывать множества таутомеров. Существование формы D [уравнение (2-4)] послужило основанием к тому, что урацил называют также диоксипиримидином (правда, здесь преобладает все же дикето-таутомер А). В паре таутомеров один из атомов водорода всегда переходит из одного положения в другое, что сопровождается изменением длин и характера других связей.
Константа равновесия для таутомерного перехода равна отношению мольных долей двух форм. Например, для енольной и кето-форм ацетона в воде это отношение равно ~2∙10-6 [8]; для биполярных ионов и незаряженного пиридоксина [уравнение (2-3)] при 25 °С оно равно ~4 [9]. Относительное содержание таутомеров урацила В, С и D по сравнению с таутомером А предположительно невелико, но количественные измерения здесь провести трудно [10, 11]. Таутомерные отношения (определяемые для полностью пратонированных форм) не зависят от pH, но меняются с изменением температуры, зависят от растворителя и весьма чувствительны к связыванию таутомеров с молекулами белка или другими молекулами.