Биохимия - Химические реакции в живой клетке Том 1 - Д. Мецлер 1980
Молекулы, из которых мы состоим
Белки
а-Аминокислоты
Для понимания свойств аминокислот как свободных метаболитов и как компонентов белковых молекул нужно прежде всего запомнить три простых факта.
1. Аминокислоты существуют преимущественно в форме биполярных ионов (цвиттерионов).
Таблица 2-2 Структура и химические свойства боковых цепей аминокислот
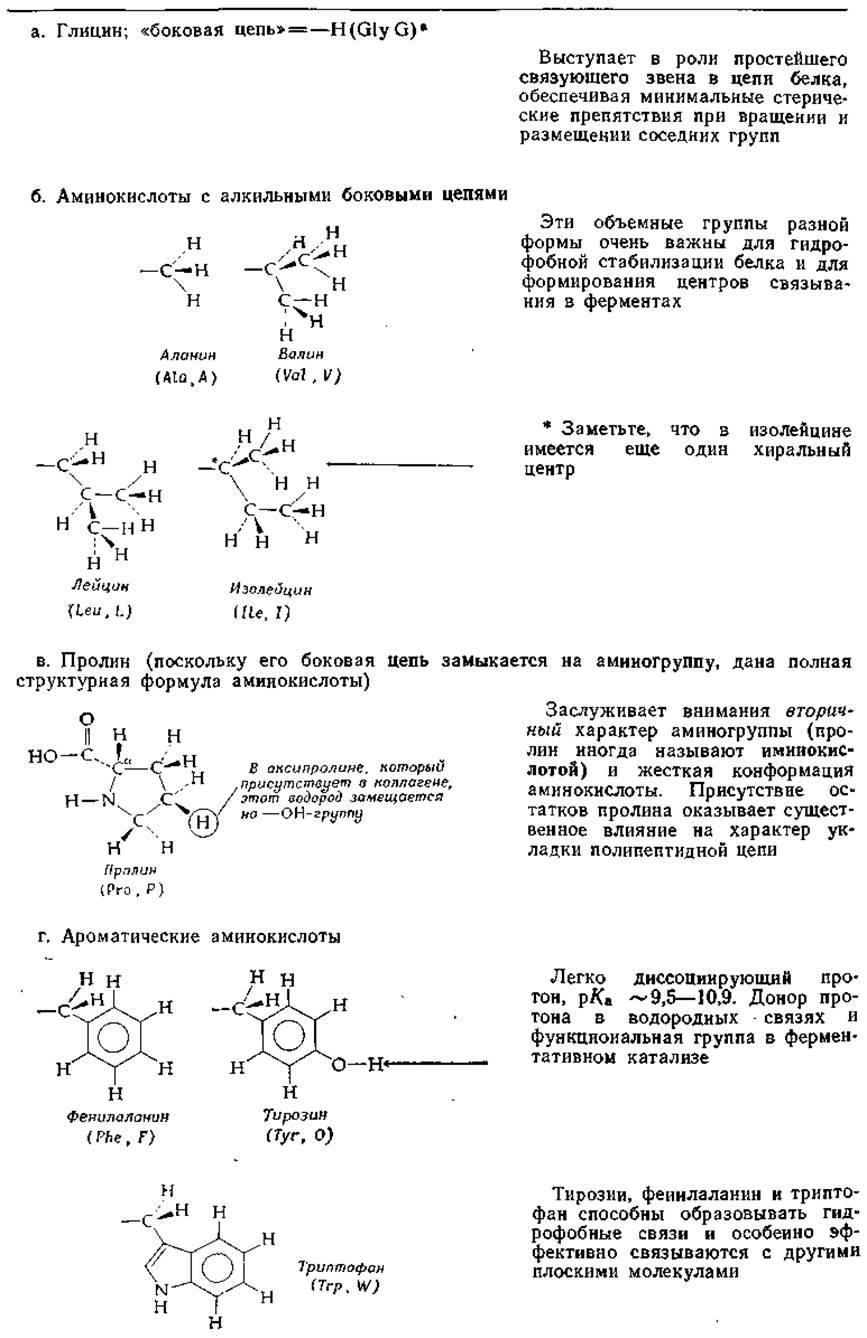


а В скобках даны трехбуквенные и однобуквенные обозначения аминокислотных. остатков, входящих в состав пептидов н белков.
2. Аминокислоты асимметричны и образуют два семейства: D и L (разд. А.4).
3. Аминокислоты отличаются друг от друга структурой боковых групп (боковых цепей), которые в приведенных выше формулах обозначались через R. Эти группы имеют разную химическую структуру. Они выступают из основной цепи и формируют в значительной степени поверхность полимера, определяя многие химические и физические свойства белков.
В табл. 2-2 приведены структурные формулы боковых цепей аминокислот, обычно встречающихся в белках (формула пролина приведена полностью). Даны также сокращенные трехбуквенные обозначения аминокислот, используемые при выписывании аминокислотных последовательностей пептидов и белков, а также однобуквенные сокращения, принятые в работах по эволюции белков и при составлении программ для вычислительных машин.
При обсуждении вопросов, связанных со структурой белков, аминокислоты, входящие в группы а, б и в, а также фенилаланин и метионин принято объединять в категорию неполярных аминокислот. Они стремятся попасть в гидрофобное окружение «внутри» молекулы белка. Противоположную по свойствам категорию составляют полярные заряженные молекулы (группы е и и), которые обычно выступают наружу, в водное окружение белка. Остальные образуют категорию полярных незаряженных аминокислот.
Знакомство со структурой аминокислот лучше всего начать с глицина, аланина, серина, аспарагиновой кислоты и глутаминовой кислоты.
Отметим, что структуру многих аминокислот можно получить из структуры аланина заменой одного из атомов водорода на другую группу. Так, замена ß-водорода аланина дает:

Метаболические взаимоотношения между аминокислотами, о которых речь пойдет позднее, помогут запомнить структуру остальных аминокислот.
В табл. 2-2 включены также значения рКа (см. гл. 4, разд. Б) боковых групп аминокислот. Если концевые амино- и карбоксильные группы свободны, они тоже могут участвовать в кислотно-основных реакциях; рКа этих групп имеет следующие значения:
![]()
Поскольку при нейтральных pH —СООН-группы глутаминовой и аспарагиновой кислот полностью диссоциированы, в биохимической литературе их принято называть глутаматом и аспартатом независимо от природы присутствующих в среде катионов. Такое же окончание (—ат) применяется и в случае других кислот — например, малат, оксоалацетат, фосфат, аденилат, что находит отображение и в названии ферментов, например лактатдегидрогеназа.