Биохимия - Химические реакции в живой клетке Том 1 - Д. Мецлер 1980
Молекулы, из которых мы состоим
Белки
Глобулярные белки
Большинство белков живой клетки характеризуется значительно более сложным способом свертывания цепи по сравнению с фибриллярными белками3. Первым белком, для которого методом рентгеноструктурного анализа была установлена полная трехмерная структура, стал миоглобин — небольшой (мол. вес 17 500) кислород-связывающий белок, присутствующий в мышцах. 153 аминокислотных остатка миоглобина распределено в основном по 8 а-спиральным участкам различной длины, содержащим от 7 до 26 остатков. Спиральные участки, имеющие вид прямолинейных стержней, расположены в пространстве весьма нерегулярным образом, как это показано на рис. 2-8. Рисунок не дает полного представления о строении белка, поскольку пространство между стержнями и внутри молекулы в действительности целиком заполнено боковыми цепями аминокислот, причем почти все они имеют гидрофобный характер. Большинство же полярных боковых цепей выступают из спиралей наружу, в окружающую водную среду.
3 Способ укладки пептидной цепи (образование спирали или ß-структуры) часто называют вторичной структурой белка. Дальнейшая укладка молекулы, основанная на взаимодействии групп, далеко отстоящих друг от друга вдоль цепи, приводит к формированию третичной структуры. Агрегация мономерных белковых субъединиц в олигомеры (гл. 4) определяет четвертичную структуру белка.
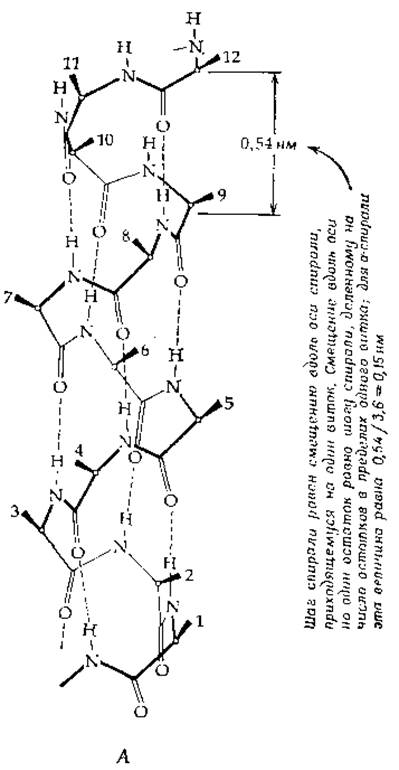
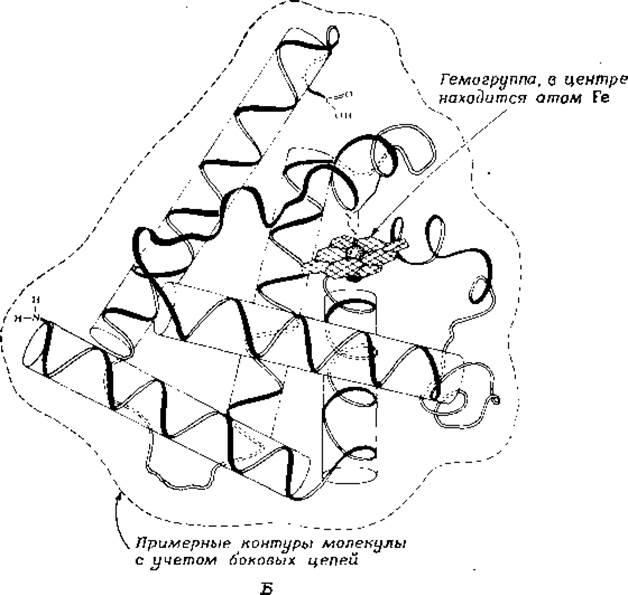
РИС. 2-8. а-Спираль. А. Правая спираль с вертикально расположенными водородными связями, изображенными в виде пунктирных линий. Положения боковых цепей аминокислот указаны цифрами в порядке возрастания от С-конца к N-концу полипептидной цепи (общепринятым для пептидной цепи является обратное направление — от N-конца к С-концу. — Перев.) Б. Конформация пептидного остова миоглобина (Kendrew J. С., Sei. Am., 205, 96—110, Dec. 1961). Пять длинных а-спиралей изображены в виде цилиндрических стержней. Видно еще несколько более коротких спиралей. Полный размер молекулы — приблизительно 4,4X4,4X2,5 нм.
По мере расшифровки структуры различных белков (особенно в последние годы) становилось все более очевидным, что глобулярные белки, как и миоглобин, сохраняют свою структуру преимущественно благодаря взаимодействию между гидрофобными остатками. Внутри молекулы белка боковые группы уложены исключительно компактно. Если где-нибудь в структуре остается свободное пространство, оно обычно заполняется водой [24, 25]. Например, плотность упаковки (отношение объема, ограниченного вандерваальсовой оболочкой, к полному объему) молекул лизоцима и рибонуклеазы составляет ~0,75; для сравнения укажем, что для плотно упакованных сфер теоретическое значение плотности упаковки равно 0,74. Полярные группы обычно находятся на поверхности, но иногда бывают «утоплены» внутрь, образуя водородные связи с другими группами внутри молекулы белка. На отдельных участках поверхности встречаются и неполярные боковые цепи, которые в ряде случаев сгруппированы в гидрофобные кластеры. Последние могут обусловливать взаимодействие с другими белками или с липидными участками мембран.
Миоглобин является в каком-то смысле исключительным белком, поскольку у большинства других глобулярных белков содержание а-спиральных участков оказывается сравнительно невысоким. Например, составленная из 129 остатков цепь лизоцима (рис. 2-9), одного из самых небольших ферментов (мол. вес 14 600), содержит лишь несколько коротких спиралей. Цепь лизоцима уложена по большей части сложным и нерегулярным образом. Обратите внимание на область, содержащую антипараллельный складчатый ß-слой. Он начинается с участка между остатками 42 и 45, далее цепь поворачивает назад, формируя петлю наподобие шпильки, и между остатками 51—54 и 42—45 образуются водородные связи. Складчатая структура просматривается и в некоторых других частях цепи.
Характерной особенностью молекул более крупных белков является наличие четко выраженной ß-структуры в центральной части молекулы. Примером может служить фермент карбоксипептидаза А, состоящий из 307 остатков (рис. 2-6, внизу) [26]. ß-Структура, изогнутая в виде лопасти левого пропеллера, образует своеобразную жесткую «основу», к которой прикрепляются остальные части молекулы. Многие белки содержат как участки, имеющие параллельную ß-структуру, так и участки с антипараллельной ß-структурой. Для ряда крупных белков, например для глицеральдегидфосфатдегидрогеназы (334 остатка), характерно присутствие четко различимых доменов (двух или более), соединенных друг с другом «шарнирными» участками [27]. Преобладающей структурой в каждом из двух доменов является складчатый ß-слой (рис. 2-10). Обратите внимание, что NАD+-связывающий домен имеет почти всюду параллельную ß-структуру, тогда как «каталитический» домен содержит как параллельные, так и антипараллельные цепи. Оба домена имеют а-спиральные участки, расположенные по обе стороны от центрального слоя.
Если трехмерную структуру лучше всего изображать в виде стереопар, то характер распределения водородных связей внутри молекулы яснее всего виден на двумерных диаграммах, одна из которых представлена на рис. 2-11.
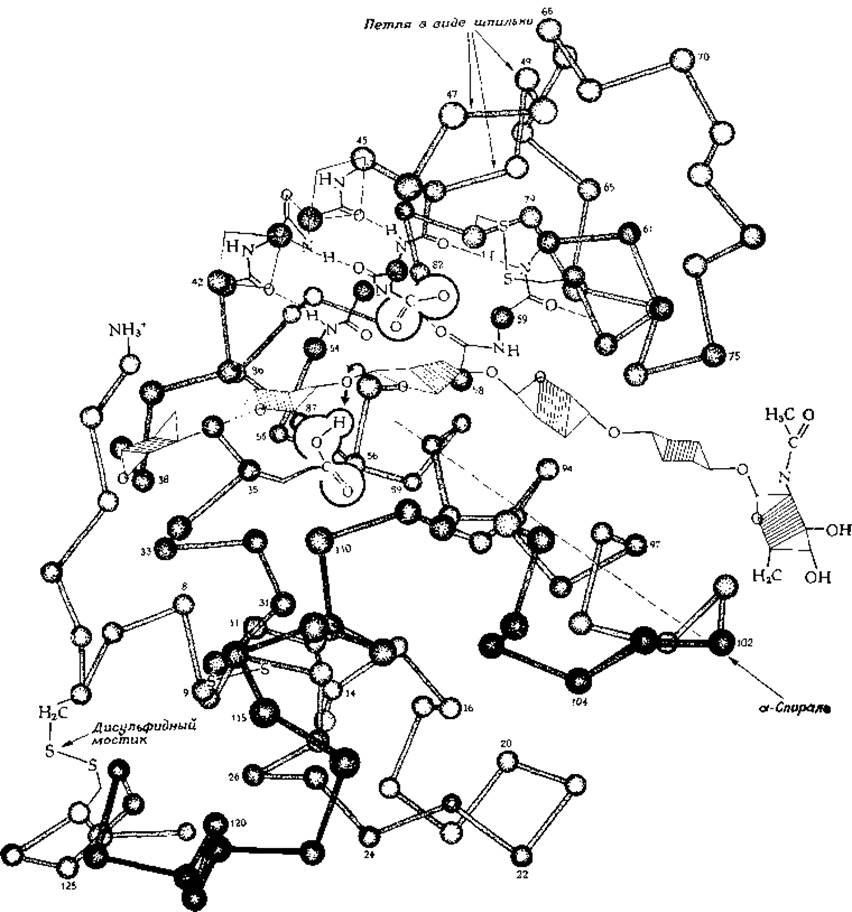
РИС. 2-9. Укладка полипептидиой цепи фермента лизоцима. (Dickerson R. Е., Geis J., The Structure and Action of Proteins, p. 71. Benjamin, New-York, 1969.) Для большей части молекулы показаны только места присоединения боковых цепей (атомы а-углерода). На одном из участков изображены также атомы, участвующие в образовании пептидной связи, что позволяет видеть расположение водородных связей в анитипараллельной ß-структуре в центральной части молекулы. Указана одна из а-спиралей. Шестиугольники, заштрихованные в средней части, изображают остов полисахаридного субстрата, связанного в «активном центре». Предполагается, что карбоксильная группа остатка 35 способствует разрыву О—С-связи (жирные стрелки) (гл. 7, разд. В.4.а). Стрелка слева указывает положение одного из трех дисульфидиых мостиков. (В действительности в молекуле лизоцима имеется четыре дисульфидиых мостика. Кроме трех, указанных на рисунке, есть еще мостик между остатками 76 и 94 — на рисунке он должен был бы проходить под молекулой субстрата. — Перев.) Видны и остальные два мостика — один находится правее и выше, а другой — левее и ниже центральной части молекулы.
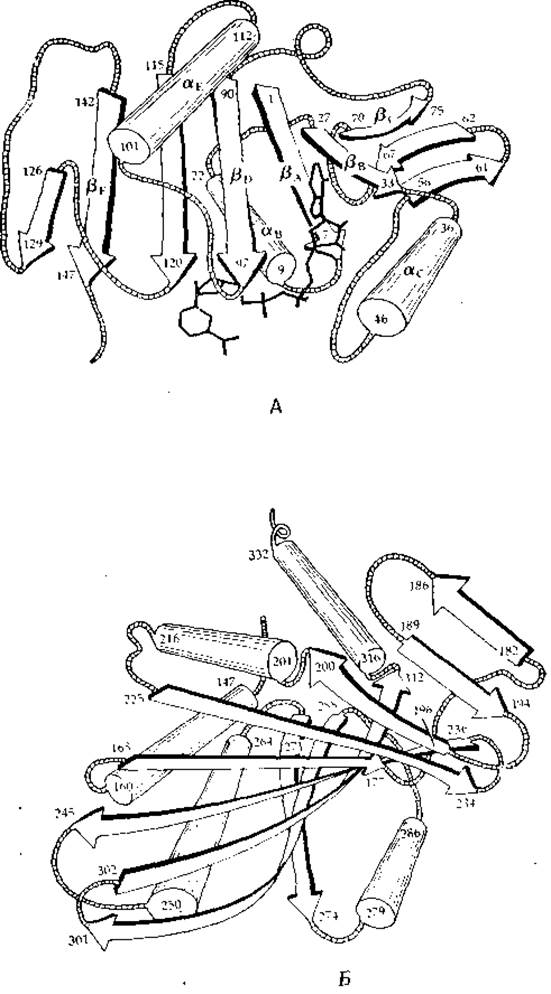
РИС. 2-10. Схематическое изображение двух доменов в молекуле глицеральдегидфосфатдегидрогеназы (из мышц омара). А. NАD+-связывающий домен. Цифры указывают номера аминокислотных остатков в последовательности; аВ, аС и т. д., ßA, ßB и т. д. обозначают соответственно а-спирали и цепи складчатого ß-слоя. Б. Каталитический домен, ориентированный так, чтобы был лучше виден складчатый слой в области контакта между субъединицами [27].
Исследование синтетических полипептидов, а также анализ известных белковых структур, полученных с помощью рентгеновской кристаллографии, показали, что некоторые аминокислоты, например глутаминовая кислота, аланин и лейцин, способствуют образованию а-спирали. Другие аминокислоты, в частности метионин, валин и изолейцин, чаще
встречаются в составе ß-структуры, тогда как глицин, пролин и аспарагин обычно расположены в местах изгиба цепи. Напрашивается вывод, что способ укладки полипептида прямо определяется его последовательностью. Так, если в каком-то месте цепи сосредоточено несколько остатков, способствующих образованию спирали, то образуется спираль. Эта спираль растет в обоих направлениях до тех пор, пока не «натолкнется» на остатки (например, пролин), препятствующие ее образованию. Подобным же образом, если сгруппированы соответствующие остатки, образуется ß-структура. Нерегулярная укладка других участков цепи приводит к образованию дополнительных водородных связей и большого числа гидрофобных связей, в особенности характерных для внутримолекулярных областей глобулярных белков.

РИС. 2-11. Схематическое изображение системы водородных связей между группами главной цепи в NAD+-связывающем домене (остатки 1 —149) глицеральдегидфосфатдегидрогеназы [27].
Теперь, когда известна трехмерная структура многих белков, пытаются предсказывать способ укладки других белковых молекул, исходя из их аминокислотной последовательности [28—30]. Один из таких методов основан на определении численным методом значений «конформационных параметров», дающих вероятность нахождения данного остатка в составе спирали, ß-структуры и ß-изгиба (табл. 2-4). Согласно Чоу и Фасману [29], если из шести сгруппированных остатков четыре способствуют образованию спирали, данную группу можно рассматривать как центр спирализации. От этого центра спираль разрастается в обоих направлениях, пока ей не встретится тетрапептид из остатков, препятствующих образованию спирали. Подобным же образом три остатка из пяти, способствующие образованию ß-структуры, играют роль затравки для формирования ß-слоя. В этом случае большое значение имеет возможность образования связей с другими участками цепи, отделенными от растущего ß-слоя ß-изгибами или участками с нерегулярной конформацией (статистический клубок). Устраивались даже своего рода конкурсы, в ходе которых разные группы исследователей пытались предсказать способ укладки цепи в белках непосредственно перед определением их структур кристаллографическими методами [31].
Таблица 2-4 Классификация аминокислотных остатков по их способности к образованию а-спирали, ß-структуры и β-изгибаа
|
Аминокислота |
Pa |
Тенденция к образованию спирали |
Тенденция к образованию ß-структуры |
Рt |
|
|
Glu- |
1 ,53 |
++ |
0,26 |
анти.+ |
0,44 |
|
Ala |
1 ,45 |
++ |
0,97 |
сл. |
0,57 |
|
Leu |
1 ,34 |
1,22 |
+ |
0,53 |
|
|
His+ |
1,24 |
+ |
0,71 |
анти. |
0,69 |
|
Met |
1,20 |
+ |
1 ,67 |
++ |
0,67 |
|
Gin |
1 ,17 |
+ |
1 ,23 |
+ |
0,56 |
|
Trp |
1,14 |
+ |
1,19 |
+ |
1,11 |
|
Val |
1,14 |
+ |
1,65 |
++ |
0,30 |
|
Phe |
1,12 |
+ |
1 ,28 |
+ |
0,71 |
|
Lys+ |
1 ,07 |
сл. |
0,74 |
анти. |
1,01 |
|
Ile |
1,00 |
» |
1 ,60 |
++ |
0,58 |
|
Asp- |
0,98 |
безр. |
0,80 |
++ |
1,26 |
|
Thr |
0,82 |
» |
1 ,20 |
+ |
1,00 |
|
Ser |
0,79 |
» |
0,72 |
анти. |
1,56 |
|
Arg+ |
0,79 |
» |
0,90 |
безр. |
1,00 |
|
Cys |
0,77 |
1,30 |
+ |
1,17 |
|
|
Asn |
0,73 |
анти. |
0,65 |
анти- |
1,68 |
|
Tyr |
0,61 |
» |
1,29 |
+ |
1,25 |
|
Pro |
0,59 |
анти. + |
0,62 |
анти. |
1,54 |
|
Gly |
0,53 |
» |
0,81 |
безр. |
1,68 |
a Конформационные параметры Ра, Рβ и Pt представляют собой частоты встречаемости данной аминокислоты в составе а-спирали, ß-структуры или ß-изгиба (по данным для 15 белков с известной структурой), деленные на среднюю частоту встречаемости данной аминокислоты в молекуле. Аминокислотные остатки в таблице расположены в порядке убывания их способности образовывать спираль. Символы «++», « + », «сл.», «безр.», «анти.» и «анти.+» означают, что аминокислота характеризуется соответственно сильной тенденцией к образованию данной структуры, умеренной тенденцией, слабой тенденцией, что ей безразлично, в какой структуре она будет находиться, что она противодействует или сильно противодействует образованию структуры данного типа [29].
Недавно Левитт и Хотиа провели классификацию группы белков, в которую они включили 31 белок с известной структурой; получились четыре четко различающиеся структурные группы. (I)∙ а-Белки, в которых, как в гемоглобине и миоглобине, преобладают а-спирали. (II) Белки, построенные из ß-слоев, расположенных один над другим и образующих многослойную структуру; в эту категорию, в частности, попадает небольшой белок рубредоксин (рис. 10-4), а также конканавалин А (рис. 5-7). (III) (a + ß)∙Белки, у которых в состав одной и той же полипептидной цепи входят участки, целиком построенные из a-спиралей, и участки, целиком состоящие из ß-слоев (как правило, антипараллельных). Примерами таких белков могут служить папаин и термолизин (гл. 7). (IV) a/ß-Белки, в которых a-спирали и ß-цепи чередуются по ходу полипептидной цепи. Обычно здесь имеется один центральный ß-слой, по обе стороны которого располагаются спиральные участки; такая ситуация имеет место, например, в карбоксипептидазе (рис. 2-6), глицеральдегидфосфатдегидрогеназе (рис. 2-10), а также в гексокиназе и фосфоглицераткиназе (рис. 7-5).