Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Типы реакций, катализируемых ферментами
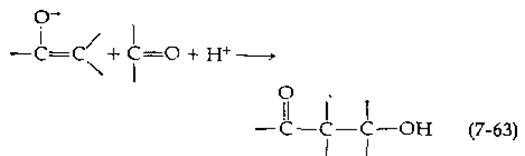
ß-Расщепление и конденсация
Присоединение енолят-аниона к карбонильной группе или к иминам (реакции типа 5.Б.)
Альдольная конденсация является одной из наиболее типичных реакций в метаболических процессах, приводящих к образованию связей С—С (при протекании обратной реакции) к их расщеплению:
а. Фруктозодифосфат-альдолаза
Наиболее известная альдолаза расщепляет (обратимо) в гликолитическом пути фруктозодифосфат на две молекулы триозофосфата:
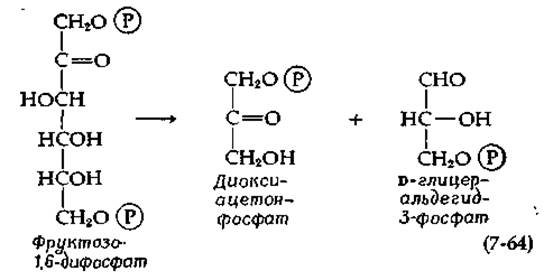
Этот фермент обнаружен во всех растительных и животных тканях, но он отсутствует в некоторых бактериях, приспособленных к определенным условиям. Хорошо изученная альдолаза из мышц кролика представляет собой белок с мол. весом ~ 160 000; это тетрамерная молекула, состоящая из четырех почти идентичных полипептидных цепей [144—146].
Обработка фермент-субстратного комплекса альдолазы с диоксиацетонфосфатом боргидридом натрия при pH 6 (0°С) приводит к образованию ковалентной связи между белком и субстратом. Эти и другие данные свидетельствуют о промежуточном образовании шиффового основания (рис. 7-10). Использовав меченный 14С субстрат и восстановление боргидридом натрия [уравнение (7-41)], получили фермент, у которого был помечен лизин активного центра. Локализацию радиоактивной метки определяли анализом последовательности аминокислотных остатков и установили, что остаток меченого лизина занимает положение 227 в цепи, состоящей из 361 аминокислоты.
Присутствие существенного для проявления ферментативной активности остатка гистидина в активном центре фермента подтверждается экспериментами по фотохимическому окислению. Например, облучение видимым светом в присутствии галоидированного флуоресцеинового красителя бенгальского розового приводит к фотоинактивации альдолазы, сопровождающейся разрушением большого числа гистидиновых остатков. Более избирательным реагентом является пиридоксальфосфат (гл. В, разд. Д), который связывается в активном центре, образуя, по-видимому, шиффово основание со вторым остатком лизина. При облучении связанного с ферментом пиридоксальфосфата в каждой субъединице разрушается один-единственный остаток гистидина (вероятно, His-359).
Реакция 5,5'-дитио-бис-2-нитробензоата [реактив Элмана; схема (2-28)] с альдолазой вызывает быстрое блокирование одной —SH-группы в каждой субъединице. Присутствие субстрата мешает протеканию реакции, откуда следует, что в активных центрах находятся и SH-группы (по-видимому, Cys-72 и Cys-336). Имеются и такие данные, из которых следует, что карбоксильная группа концевого Туr-361 располагается в активном центре или вблизи от него [146].
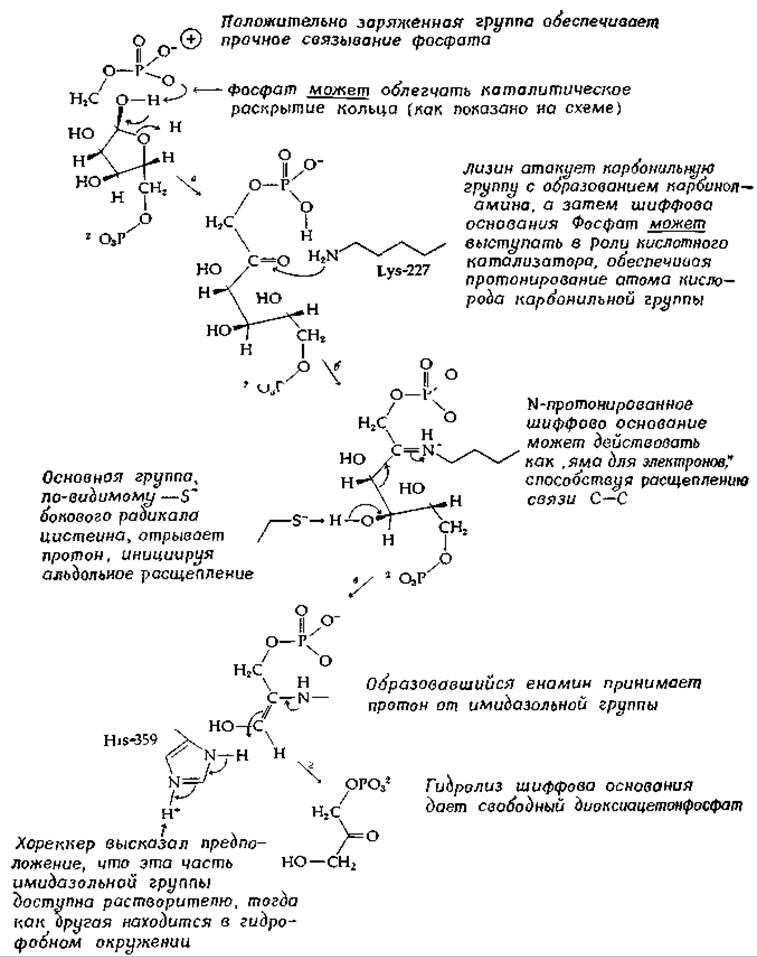
РИС 7-10 Возможный механизм действия фруктозо-1,6-дифосфат—альдолазы.
На основании этих данных Лей и Хореккер [145] предложили гипотетическую последовательность химических превращений, происходящих в активном центре альдолазы (рис. 7-10). Как показано на этой схеме, фермент катализирует раскрытие циклической формы фруктозодифосфата, причем в этой реакции, возможно, участвует фосфатная группа субстрата [147]. Реакция ß-расщепления может быть инициирована —S--гpyппoй. Предполагается, что имидазольная группа активного центра служит донором протона, который, как было показано, присоединяется к тому же положению (стереохимически), какое занимала связь между атомами углерода в фруктозо-1,6-дифосфате. Высказано предположение, что перенос протона имидазольной группы осуществляется внутри гидрофобной области фермента, как описано в гл. 2 (разд. А.9).
Альдолаза является одним из ферментов, проявляющих особую склонность к взаимодействию с тетранитрометаном. Это соединение реагирует относительно медленно с тирозильными группами с образованием 3-нитротирозильных групп:
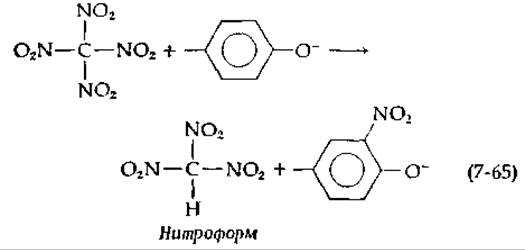
Побочный продукт этой реакции, нитроформ, имеет интенсивно желтую окраску (ε350 =14 400 М-1∙см-1) [148]. Тетранитрометан окисляет также SH-группы и реагирует с другими анионными группами. Альдолаза превращает тетранитрометан в нитроформ гораздо быстрее в присутствии субстрата, чем в его отсутствие. Отсюда следует, что этот реагент, который можно рассматривать как источник электрофильного нитроний-иона NО+2, конкурирует с имидазольной группой в реакции взаимодействия с образующимся в качестве промежуточного продукта енамином (рис. 7-10).
б. Изоферменты альдолазы
В большинстве тканей млекопитающих имеется три изофермента альдолазы: А, В и С. Изоферменты А и С содержатся преимущественно в тканях эмбрионов, а в дифференцированных тканях взрослых преобладает изофермент В.
В некоторых опухолях вместо изофермента В появляется эмбриональная форма А. Это особенно характерно для плохо дифференцированных (высокодедифференцированных) и быстро растущих опухолей, например для некоторых гепатом.
в. Два класса альдолаз
Подобно фруктозо-1,6-дифосфат—альдолазе из животных тканей, большое число других альдолаз также инактивируется боргидридом натрия в присутствии субстрата. Этот тип альдолаз («класс I») не требует металлов и не ингибируется ЭДТА. В то же время альдолазы бактерий и грибов ингибируются ЭДТА и содержат в активных центрах металл (обычно Zn2+). Альдолазы этого типа («класс II») не инактивируются боргидридом натрия в присутствии субстрата. Читателю предлагается подумать о механизме действия этих ферментов и о роли металла в ферментативном процессе.
Некоторые сине-зеленые водоросли, а также жгутиковые Euglena и Chlamydomonas содержат альдолазы обоих классов.
г. Трансальдолаза
Важный фермент, участвующий в пентозофосфатных путях (гл. 9, разд. Д,3), катализирует альдольное расщепление одного субстрата, такого, как фруктозо-1,6-дифосфат, но при этом вместо высвобождения свободного диоксиацетонфосфата происходит перенос этой группы, состоящей из трех атомов углерода, на другую альдозу [149]. По-видимому, механизм действия трансальдолазы [уравнение (9-15)] в основном напоминает механизм действия фруктозо-1,6-дифосфат—альдолази.
д. Другие альдолазы
Имеется большое число альдолаз, катализирующих в различных метаболических превращениях расщепление и образование связи С—С. Значительная часть этих ферментов действует на субстраты, содержащие 2-кето-З-дезоксигруппу [150]. В результате расщепления этих субстратов в качестве одного из продуктов образуется пируват:
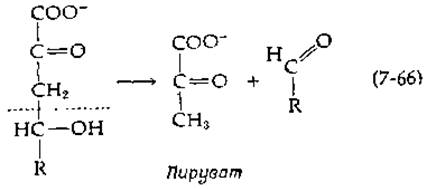
При окислении углеводов по пути Энтнера — Дудорова (гл. 9, разд. Д.4) 2-кето-3-дезокси-6-фосфоглюконат расщепляется с образованием пирувата и глицеральдегид-3-фосфата. Состоящая из восьми атомов углерода сахарная кислота «KDO» клеточных стенок бактерий (рис. 5-10) расщепляется другой альдолазой. В результате катаболических превращений оксипролина образуется 4-окси-2-кетоглутарат, который расщепляется до пирувата и глиоксилата. Альдолаза, участвующая в катаболизме дезоксинуклеотидов, расщепляет 2-дезоксирибозо-5-фосфат до ацетальдегида и глицеральдегид-3-фосфата.
е. Синтетазы поликарбоновых кислот1)
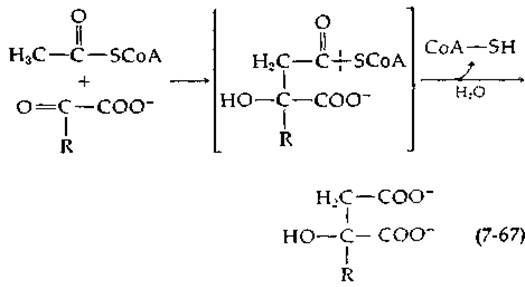
Ряд ферментов, в том числе и ключевой фермент, катализирующий образование лимонной кислоты на первой стадии цикла трикарбоновых кислот, обусловливает альдольную конденсацию ацетил-СоА с кетонами:
1) Согласно классификации, рекомендуемой Международным биохимическим союзом (гл. 6, разд. Ж), эти ферменты относятся к классу лиаз и не должны называться синтетазами. Последнее название закреплено за лигазами. В соответствии с рекомендациями Международного биохимического союза в тех случаях, когда необходимо подчеркнуть синтетический аспект реакций, катализируемых лиазами, может быть использован термин синтаза. Однако использование двух близких по написанию слов, синтаза и синтетаза, приводит к путанице и многим биохимикам представляется совершенно ненужным. В настоящей книге используется только термин синтетаза.
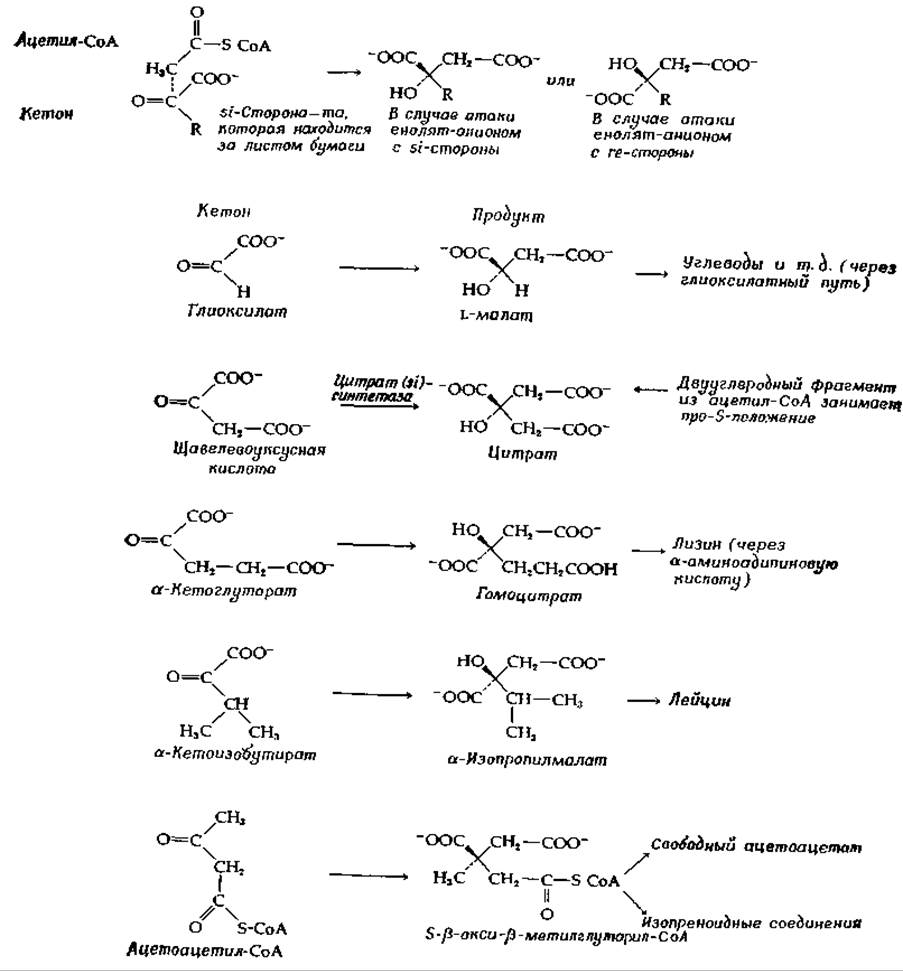
РИС. 7-11. Исходные соединения и продукты в реакциях, катализируемых некоторыми синтетазами поликарбоиовых кислот.
Роль второго субстрата чаще всего выполняет a-кислота, а соединение, указанное в скобках, по-видимому, является промежуточным продуктом реакции [151]. Однако в некоторых случаях ацетильная группа может быть перенесена с ацетил-CoA на SH-гpyппy фермента до стадии конденсации [151а]. Этот же фермент катализирует вторую стадию — гидролиз эфира СоА. Эти ферменты играют важную роль в биосинтезе. Они принимают участие в первых стадиях процесса удлинения общей цепи (гл. 11, разд. Г,7). Одна из функций тиоэфирной группы в ацетил-СоА состоит в активации водородов метальной группы в реакции альдольной конденсации. Кроме того, последующий гидролиз тиоэфирной связи обеспечивает общую необратимость процесса в целом и является «движущей силой» синтетической реакции.
На рис. 7-11 показана стереохимия реакций и, кроме того, приведен перечень кетонов, принимающих участие в реакции, и продуктов реакции. Эти ферменты могут быть разделены на две группы в зависимости от того, с какой стороны карбонильной группы происходит атака енолят-анионом. Обычная цитрат-синтетаза из тканей животных конденсируется с si-стороной и обозначается как цитрат (si)-синтетаза. В то же время в некоторых анаэробных бактериях содержится цитрат (rе)-синтетаза, проявляющая противоположную стереоспецифичность [152, 153].
ж. Хиральные ацетаты и их использование в стереохимических исследованиях
Рассмотрим последовательность ферментативных реакций:
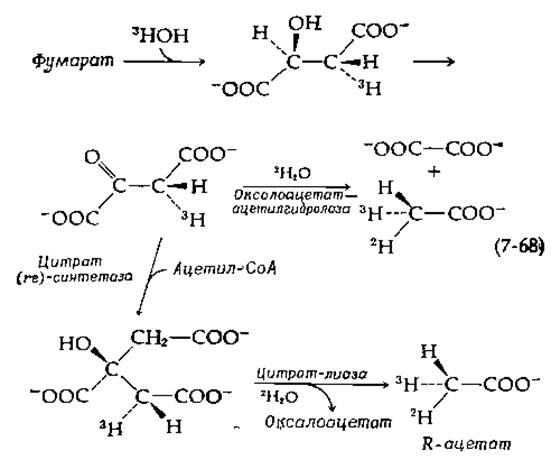
Гидрaтация фумарата проведена в тритированной воде, и образовавшийся малат окислен в оксалоацетат. Гидролиз последнего в присутствии оксалоацетат—ацетилгидролазы [уравнение (7-61)] в 2Н2O приводит к образованию оксалоацетата и хирального (R) ацетата. Тот же самый продукт может быть получен путем конденсации оксалоацетата с ацетил-СоА при использовании цитрат (rе)-синтетазы. Образующийся цитрат расщепляется в 2Н2O в присутствии цитрат-лиазы, имеющей si-спeцифичность [154, 155]. Ацетат противоположной хиральности может быть получен ферментативным путем исходя из 2,3-3Н-фумарата, гидратированного обычной водой1) в присутствии фумаразы. Хиральные ацетаты получены также неферментативным путем [154], и их конфигурация надежно установлена.
Интересным фактом, касающимся стереохимии действия как оксалоацетат—ацетилгидролазы, так и цитрат-лиазы [уравнение (7-68)], является инверсия конфигурации, происходящая у атома углерода, несущего отрицательный заряд в отщепляющемся енолят-анионе. Эта инверсия, происходящая также при действии цитрат (rе)-синтетазы и других родственных ей ферментов, была продемонстрирована при использовании хиральных ацетатов [154, 155]. Результаты, полученные с малат-синтетазой, показаны в приведенном ниже уравнении:

1) Джону В. Корифорту в 1975 г. была присуждена Нобелевская премия за серию работ, включающих и эту [см. Science, 173, 121 —125 (1976), где напечатана его Нобелевская лекция].
Вероятно, основная группа В в молекуле фермента отрывает протон, что приводит к образованию планарного енолят-аниона. Второй субстрат, глиоксилат, приближается с другой стороны молекулы и конденсируется, как показано в уравнении (7-69). Благодаря этому уравнению читатель получает возможность понять, каким образом была доказана инверсия. Поскольку основание В может отщеплять любой из трех протонов, принадлежащих либо R-, либо S-хиральному ацетил-СоА, возможно несколько вариантов расположения изотопов в образующемся L-малате. Однако задача была успешно решена, после того как было установлено, что про-R-водород у атома С-3 малата избирательно обменивается с водой при действии фумаразы.
з. Ферменты, расщепляющие лимонную кислоту
В организме эукариот синтез цитрата протекает в митохондриях, но в определенных условиях цитрат перемещается в цитоплазму, где он расщепляется под действием цитрат-лиазы. Полное течение реакции обеспечивается ее сопряжением с гидролизом АТР до ADP и неорганического фосфата:
![]()
Последовательность реакций, приведенная в уравнении (7-71), довольно сложна, но ее нетрудно понять, если рассматривать как процесс, включающий начальный синтез цитрил-СоА по механизму, аналогичному механизму реакции (7-29).
1) Положение равновесия сильно зависит от концентрации ионов Mg2+ вследствие сильного хелатирования Mg2+ цитратом [156].
Однако имеются данные об образовании фосфофермента и цитрилфермента как промежуточных соединений: [152]:
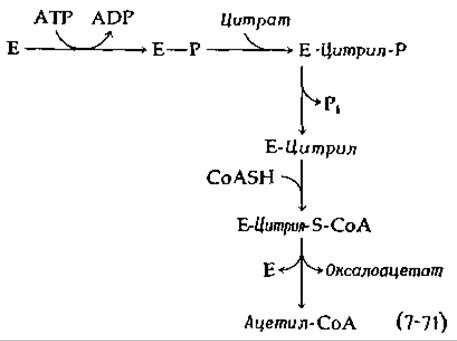
Протекающее с участием АТР расщепление малата до ацетил-СоА и глиоксилата включает ту же последовательность реакций, но нуждается в двух ферментах, причем в качестве промежуточного соединения образуется малил-СоА [157].
Индуцируемая субстратом цитрат-лиаза была обнаружена у небольшого числа бактерий, осуществляющих анаэробную диссимиляцию цитрата. Цитрат расщепляется до оксалоацетата и ацетата. Имеются доводы в пользу того, что до стадии альдольного расщепления фермент, который первоначально находился в ацетилированной форме, вступает в реакцию ацильного обмена, приводящего к образованию цитрилфермента:
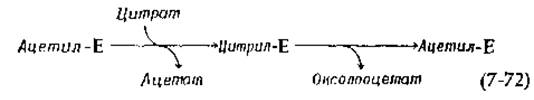
Фермент представляет собой белок с высоким мол. весом (~585 000), олигомерные молекулы которого имеют состав (аßy)6. Малая субъединица (у) имеет мол. вес ~ 10 000 и содержит необычное, ковалентно связанное производное кофермента А [158, 158а].
Первый уникальный фермент весьма важного глиоксилатного пути (гл. 11, разд. Г,4), изоцитрат-лиаза, катализирует расщепление изоцитрата до сукцината и глиоксилата:

Этот фермент может существовать в сукцинилированной форме [152], механизм распада которой аналогичен механизму реакции (7-72).