Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Коферменты - особые природные специализированные реагенты
Кетокислоты и другие необычные электрофильные центры
Декарбоксилазы
Некоторые ферменты, которые, казалось бы, должны были иметь в активных центрах пиридоксальфосфат, вместо него содержат связанные а-кетокислоты. Эти и некоторые, видимо родственные, ферменты с необычной функцией мы рассмотрим в данном разделе.
У некоторых биологических видов декарбоксилазы гистидина [56] и S-аденозилметионнна [57] содержат в активном центре ковалентно связанную кетокислоту. Эти ферменты ингибируются карбонильными реагентами и боргидридом. Если для восстановления гистидиндекарбоксилазы Lactobacillus использовался 3Н-содержащий боргидрид, то происходило включение 3Н, который после гидролиза обнаруживался в составе молочной кислоты. Это указывает на наличие остатка пировиноградной кислоты, присоединенного посредством амидной связи и претерпевающего следующие реакции:
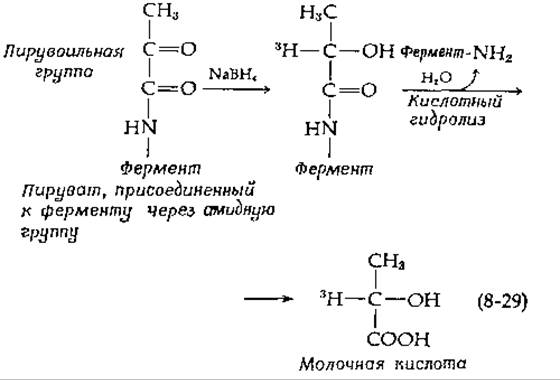
Восстановление боргидридом в присутствии гистидина приводит к образованию ковалентной связи между этим субстратом и связанным пируватом. Таким образом, так же как и у PLP-содержащих декарбоксилаз, образуется шиффово основание с субстратом. При декарбоксилировании, по-видимому, используется способность карбонильной группы амида акцептировать электроны [уравнение (8-30)].

Когда микроорганизмы, продуцирующие гистидиндекарбоксилазу, выращивали на среде, содержащей меченный 14С серин, то 14С включался в связанную пирувоильную группу. Таким образом, серин является предшественником связанного пирувата. Фермент вырабатывается клетками в форме более длинного профермента с мол. весом ~ 37 000, который расщепляется на две полипептидные цепи. Один полипептид, с мол. весом ~ 28 000 содержит N-концевой пирувоильный остаток, а- другой с мол. весом ~9000 содержит С-концевой серин [58]. Активация протекает самопроизвольно при инкубации профермента в течение 24—48 ч при pH 7 и 37°С. Замещенные остатки серина в слабощелочной среде легко подвергаются а,β-элиминированию с образованием остатков дегидроаланина. Превращение профермента в активную гистидиндекарбоксилазу могло происходить в результате такого элиминирования с последующим избирательным гидролизом [уравнение (8-31)] [58].
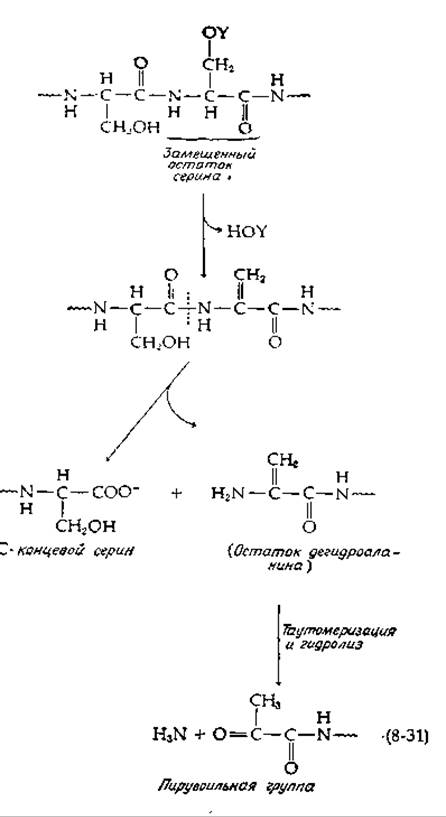
Эта гистидиндекарбоксилаза необычна и в том отношении, что молекула фермента содержит по 5 субъединиц из цепей с мол. весом 9000 и 28 000 и обладает поворотной симметрией пятого порядка. Профермент также является пентамером.