Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Коферменты - особые природные специализированные реагенты
Флавиновые коферменты
Ковалентно связанные и другие модифицированные флавиновые коферменты
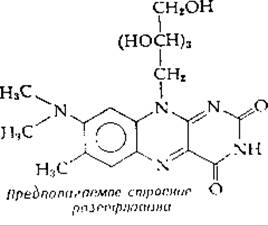
Чрезвычайно активным флавинсодержащим ферментом митохондрий животных является сукцинатдегидрогеназа [реакция (8-49)]. Этот фермент не только сам прочно встроен в мембраны крист митохондрий, но и содержит флавин, прикрепленный к белку с помощью ковалентной связи. Недавно была выяснена химическая природа этой связи: выделен модифицированный FAD, содержащий 8а-(N-3-гистидил)-рибофлавин [103—105]:
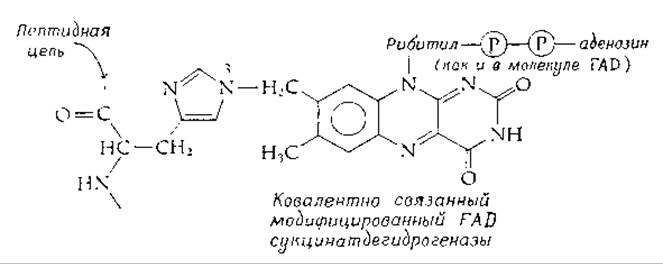
Та же самая простетическая группа была обнаружена в 6-оксиникотиноксидазе Athrobacter oxidans [106] н, вероятно, имеется в саркозин (N-метилглицин)—дегидрогеназе [107]. В моноаминоксидазе печени FAD прикреплен через то же 8а-положение к атому серы остатка цистеина [108, 109]. Во «флавоцитохроме» (цитохроме c552 Chromatium) обнаружен, однако, другой тип ковалентной связи, тиополуацетальный [110]. Цитохром b-редуктаза также содержит ковалентно связанный флавин [111]. Интересно будет узнать, как много вариаций на эту тему создала природа.
NADH-дегидрогеназа Peptostreptococcus elsdenii содержит наряду с FAD большое количество 6-окси-FAD и 8-oкси-FAD (в котором 8-метильная группа заменена на ОН-группу) [112], однако биологическое значение этого явления пока не выяснено. Другой модифицированный флавин, розеофлавин, является не коферментом, а антибиотиком, выделенным из Streptomyces davawensis. Вероятная структура его выявлена методом рентгеноструктурного анализа [113].