Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Ферменты: белковые катализаторы клеток
Ингибирование и активация ферментов
Изотопный обмен в равновесных условиях
Рассмотрим взаимодействие субстратов А и В, приводящее к образованию продуктов Р и Q:
![]()
Если в системе наряду с ферментом присутствуют оба субстрата и оба продукта, причем в соотношении, соответствующем равновесному, то скорость суммарной реакции будет равна нулю, но субстраты и продукты будут продолжать взаимно превращаться под действием фермента. Внеся в систему небольшое количество меченого субстрата (А* или В*) с высокой удельной радиоактивностью, можно измерить скорость, с которой радиоактивная метка переносится от меченого субстрата тому или иному продукту. Во многих случаях метка, связанная с молекулой А, появляется только в одном из продуктов, например в Q, а метка, связанная с молекулой В, — только в продукте Р (Р — продукт, который по своей структуре наиболее близок субстрату В).
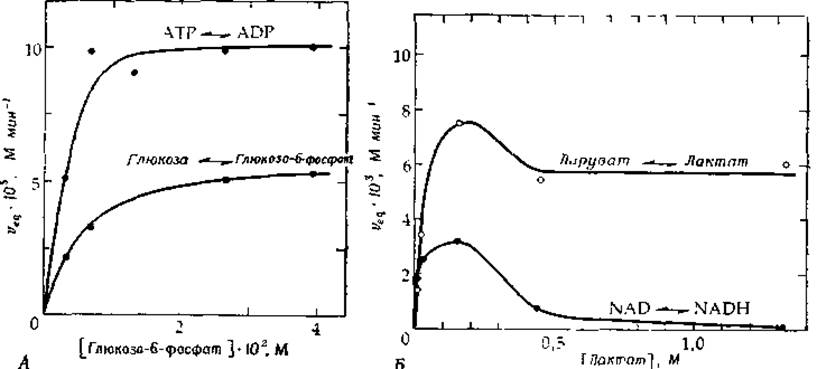
РИС. 6-9. А. Зависимость скорости реакции, катализируемой дрожжевой гексокиназой в равновесных условиях (veq), от концентрации глюкозо-6-фосфата при постоянном отношении концентрации глюкозы к концентрации глюкозо-6-фосфата, равном 1/19 [37]. Реакционные смеси содержали 1—2,2 мМ АТР и 25,6 мМ ADP (pH 6,5). Б. Зависимость скорости реакции, катализируемой лактатдегидрогеназой из скелетных мышц кролика в равновесных условиях (veq), от концентрации лактата при постоянном отношении концентрации пирувата к концентрации лактата, равном 1/35 [38]. Реакционные смеси содержали 1,7 мМ NAD, 30—46 мкМ NADH (трис-цитратный буфер, pH 7,9; 25°С).
На рис. 6-9, А приведены кривые, представляющие собой зависимость скорости обмена Глюкоза*⇄Глюкозо-6-фосфат, катализируемого ферментом гексокиназой (гл. 7, разд. Д, 6), от концентрации глюкозо-6-фосфата при постоянном отношении [Глюкоза]/[Глюкозо-6-фосфат], равном 1/19 (благодаря чему между концентрациями субстратов и продуктов всегда поддерживается соотношение, соответствующее равновесному). Как видно из рисунка, скорость этой обменной реакции, а также реакции ATP⇄ADP, монотонно возрастает с ростом концентрации субстрата. Этот факт свидетельствует о неупорядоченном связывании субстратов [37], а различие в максимальных скоростях обменных реакций указывает на то, что высвобождение глюкозо-6-фосфата из комплекса с ферментом происходит, по-видимому, медленнее, чем высвобождение ADP.
На рис. 6-9, Б представлены соответствующие зависимости для лактатдегидрогеназы (по данным работы t[38]). В этом случае скорость обменной реакции Пируват*⇄Лактат по мере увеличения концентрации пирувата достигает сравнительно высокого постоянного значения1) (отношение [Пируват]/[Лактат] постоянно и составляет 1/35). В то же время скорость обменной реакции NAD+⇄NADH сначала быстро возрастает, а затем резко падает. Это означает, что имеет место упорядоченный механизм [схема (6-34)], в котором А и Q соответствуют-NAD+ и NADH, а В и Р — пирувату и лактату. При очень высоких концентрациях В и Р фермент совершает челночное движение между формами ЕА и EQ, распад которых на свободный фермент и А или Q происходит очень редко, отчего скорость обмена A*⇄Q оказывается весьма низкой.
1) Тому, что зависимость проходит через максимум, не придается особого значения.
Метка может переходить также от А к Р или от В к Q. Как мы увидим далее, данные об обменных реакциях подобного типа очень полезны для дифференциации кинетических механизмов ферментативных реакций.