Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
О том, как электроны встречаются с кислородом, как при этом образуется ATR и о некоторых родственных явлениях
Цепь переноса электронов и окислительное фосфорилирование
Химическая активность митохондрий
Упоминание о митохондриях обычно вызывает у биохимиков представление о цикле трикарбоновых кислот, ß-окислительном пути метаболизма жирных кислот и окислительном фосфорилировании. Помимо этих главных процессов в митохондриях протекает множество других химических превращений. Вероятно, наиболее существенное из них — это концентрирование ионов, таких, как ионы Са2+. Митохондрии также контролируют приток и отток многих соединений, в том числе и АТР. Таким образом, они выполняют важные регуляторные функции как в катаболических процессах, так и в процессах биосинтеза. По мере своего роста и размножения митохондрии синтезируют часть своих белков, а ряд других белков получают из цитоплазмы.
Где же внутри митохондрии локализованы специфические ферменты? Один из подходов к выяснению этого вопроса состоит в исследовании выхода ферментов из митохондрий. Некоторые ферменты легко выходят наружу в гипотонической среде. Другие освобождаются только при действии ультразвука, из чего следует, что они находятся в митохондриальном матриксе. Ряд ферментов, в том числе цитохромы и флавопротеиды, действующие на сукцинат и NADH, настолько прочно связаны с митохондриальными мембранами, что могут быть солюбилизированы только после обработки детергентами. Согласно существующим представлениям, эти прочно связанные ферменты встроены во внутреннюю мембрану.
Если (как принято считать) ферменты цикла трикарбоновых кислот и ß-окисления локализованы в матриксе, то восстановленные переносчики должны, по-видимому, подходить к внутренней мембране со стороны матрикса (с М-стороны). Таким образом, встроенные в мембрану ферменты, осуществляющие окисление NADH, сукцината и других восстановленных субстратов, должны быть доступны со стороны матрикса. Однако флавопротеид а-глицерофосфат—дегидрогеназа оказывается доступным с «наружной стороны» внутренней мембраны (с С-стороны).
Специфические флуоресцирующие антитела, специфичные к цитохрому с, связываются только с С-стороны внутренней мембраны, а антитела к цитохромоксидазе — с обеих сторон; это дает основание думать, что этот белок пронизывает всю мембрану [66, 66а]. Однако окисление цитохрома с (с участием цитохрома а) происходит только на С-стороне, а восстановление О2 (при участии цитохрома а3) —только на М-стороне [66]. Далее, антитела к «фактору сопряжения», образующего шишковидные выступы, связываются только со стороны матрикса.
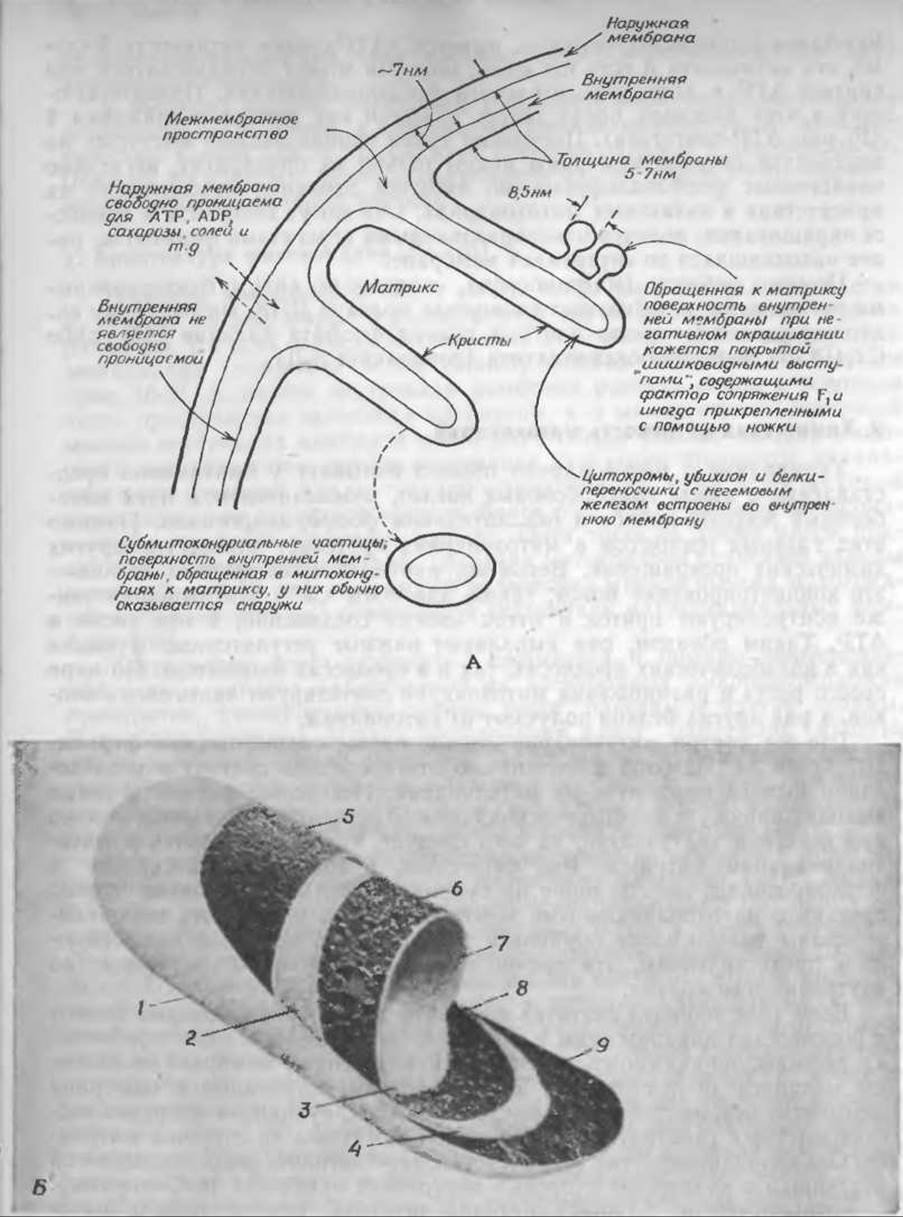

РИС. 10-9. А. Схема строения митохондрии. Б. Модель организации частиц в митохондриальных мембранах, основанная на электронно-микроскопических снимках сколов замороженных препаратов Характерные структурные черты видны на четырех поверхностях, обнажающих среднюю часть наружной и внутренней мембран (EF и PF). Четыре поверхности гладких мембран (ES и PS) выявлены методом травления (см. дополнение 1-В) Из работы Пэккера и Уортингтона [59а]. 1 — Р-поверхность наружной мембраны (PS), 2—Е поверхность внутренней мембраны (ES), 3 — Р-поверхность внутренней мембраны (PS), 4 — Е-поверхность наружной мембраны (ES), S — Е-поверхность скола наружной мембраны (EF), 6 — P-поверхность внутренней мембраны (PF), 7 — матрикс, 8 — Е-поверхность внутренней мембраны (EF), 9 — Р-поверхность скола наружной мембраны (PF). В. Митохондрии на тонком срезе выращенных в культуре почечных клеток куриного эмбриона С любезного согласия Джуди Уолтон (Judie Walton).
На основании этих и других результатов была составлена схема, приведенная на рис. 10-10, Б.
Наружная митохондриальная мембрана содержит моноаминоксидазу и цитохром b5, а также и другие белки. По своему составу она, вероятно, похожа на мембраны эндоплазматического ретикулума. Для межмембранного пространства (между внутренней и наружной мембранами) одним из характерных ферментов считается аденилаткиназа (миокиназа) [67] — ключевой фермент, участвующий в поддерживании равновесия между ATP, с одной стороны, и АМР и ADP — с другой (дополнение 3-A; гл. 7, разд. Д,6)1).
В каких концентрациях представлены в митохондриальных мембранах переносчики электронов? В одном из экспериментов было показано, что концентрация цитохромов в митохондрии печени составляет 0,28 мкмоль/г белка. Если мы примем, что общая концентрация белков в митохондрии составляет примерно 22%, то средняя концентрация цитохрома составит ~0,06 мМ. Поскольку цитохромы сосредоточены во- внутренней мембране, на долю которой приходится 10% или чуть меньше объема всей митохондрии, то концентрация цитохромов в этой мембране должна приближаться к значению 1 мМ. Этого достаточно для быстрого протекания их реакций с субстратами. Имеется много аналитических данных об относительном содержании различных компонентов дыхательной цепи (табл. 10-1).
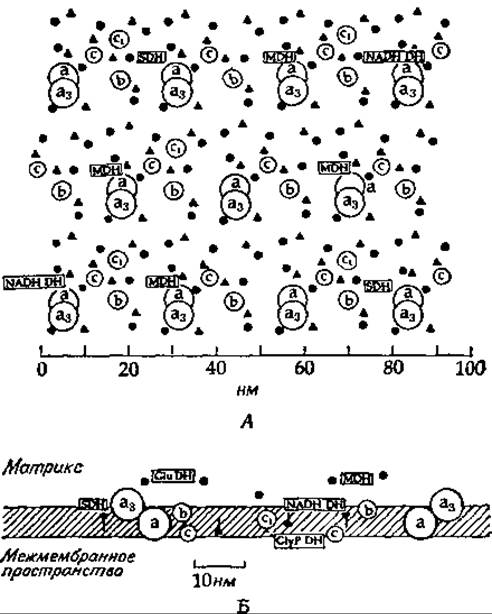
РИС. 10-10. А. Предполагаемое распределение ферментов во внутренней мембране митохондрий, основанное на аналитических данных для митохондрий сердечной мышцы. Сокращении: а, а3, b, с, с3 — цитохромы; NADH-DH. GluDH, GlyP-DH, MDH, SDH — дегидрогеназы NADH, глутамата, глицерофосфата, малата и сукцината; (▲) — убихияон, (●) — NAD. Б. Предполагаемая трансмембранная локализации некоторых переносчиков дыхательной цепи н дегидрогеназ. Из работы Крeгера и Клингенберга [67а].
Крёгер и Клингенберг [67а] изобразили распределение ферментов во внутренней митохондриальной мембране таким образом, чтобы лучше представить, на что же в действительности похожа поверхность мембраны (рис. 10-10). Конечно, мы не знаем, расположены ли белки в мембране регулярным образом или они беспорядочно плавают в мембране, соприкасясь друг с другом в процессе диффузии.
1) В ядре и цитоплазме в несколько меньших количествах присутствуют изоферменты аденилатхиназы[68].
Таблица 10-1 Относительное содержание компонентов в митохондриальной цепи переноса электронова,б
|
Переносчик электронов |
Митохондрии печени крысы |
Митохондрии сердечной мышцы быка |
|
Цитохром а3 |
1,0 |
1,1 |
|
Цитохром а |
1,0 |
1,1 |
|
Цитохром b |
1,0 |
1,0 |
|
Дитохром c1 |
0,63 |
0,33—0,51 |
|
Цитохром с |
0,78 |
0,66—0,85 |
|
Пиридиниуклеотиды |
24 |
|
|
Флавины |
3 |
1 |
|
Убихинои |
3—6 |
7 |
|
Медь |
2,2 |
|
|
Негемовое железо |
5,5 |
а По данным Вайнно [59] и цитируемым им работам.
б Приведены молекулярные соотношения. Данные для цитохромов приведены в расчете на гемогруппу.