Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
О том, как электроны встречаются с кислородом, как при этом образуется ATR и о некоторых родственных явлениях
Цепь переноса электронов и окислительное фосфорилирование
Теории окислительного фосфорилирования и модельные эксперименты
Было предложено множество схем образования высокоэнергетических промежуточных соединений в результате переноса электронов. В этом случае естественна аналогия с субстратным фосфорилированием, при котором высокоэнергетические промежуточные соединения образуются при переходе электронов от субстрата к субстрату. Как мы уже видели (гл. 8, разд. 3,5), альдегидная группа глицеральдегид-3-фосфата превращается в ацилфосфат, который после переноса фосфатной группы на ADP освобождается в виде карбоксилатной группы. В этом процессе свободная энергия окисления альдегида в карбоксильную группу расходуется на синтез АТР. Реакция отличается от митохондриального переноса электронов тем, что продукт 3-фосфоглицериновая кислота уже не превращается обратно в глицеральдегид-3-фосфат. В то же время переносчики электронов дыхательной цепи должны быть регенерированы в каком-то циклическом процессе. Последнее требование вынуждает искать какие-то иные механизмы окислительного фосфорилирования.
а. Теории, основанные на особых химических свойствах электронпереносящего кофермента или простетической группы
Обзор различных теорий окислительного фосфорилирования [82, 83] удобно начать, обращаясь снова к уравнению (10-11)1). Липман [84] предложил общую схему, соответствующую этому уравнению. Последовательность реакций начинается с присоединения группы Y'—ОН [группы Y в уравнении (10-11)] по соответствующей двойной связи между атомами углерода в переносчике ВН2. Хотя реакции изотопного обмена (разд. Д,5) исключают возможность функционирования в качестве Y как ADP, так и Рі, все же привлекательно предположение об участии в этом процессе связанного фосфат-иона, принадлежащего, например, фосфолипиду или коферменту. Бедный энергией аддукт Y—ВН2 [уравнение (10-11)] путем окисления превращается в соединение Y~B, близкое по реакционноспособности к ацилфосфату или тиоэфиру.
Важно учитывать, что независимо от природы соединения Y~B фрагмент группы Y остается связанным после переноса Y на X. Таким образом, уравнение (10-11) будет более полным, если Y заменить на Y'OH. В этом случае образующееся соединение имеет форму X~Y', а переносчик остается в форме В—ОН. Для регенерации В необходимо элиминировать гидроксильную группу. При поиске подходящего химического механизма этих стадий окислительного фосфорилирования одна из проблем связана с необходимостью, чтобы такая гидроксильная группа легко элиминировалась.
Хотя в уравнении (10-11) соединение Y присоединяется к восстановленной форме переносчика В с последующим окислением В выcокоэнергетическую форму окисленного переносчика, возможно присоединение Y и к окисленной форме переносчика В. Затем В—Y будет восстанавливаться в форму BH2~Y— высокоэнергетическую форму восстановленного переносчика. После реакции с группой X [как в уравнении (10-11)] останется модифицированный восстановленный переносчик В'Н2, который при последующем элиминировании снова перейдет в форму ВН2, завершив в результате цикл. Таким образом, нам следует иметь в виду возможность как окисленной, так и восстановленной высокоэнергетических форм переносчика.
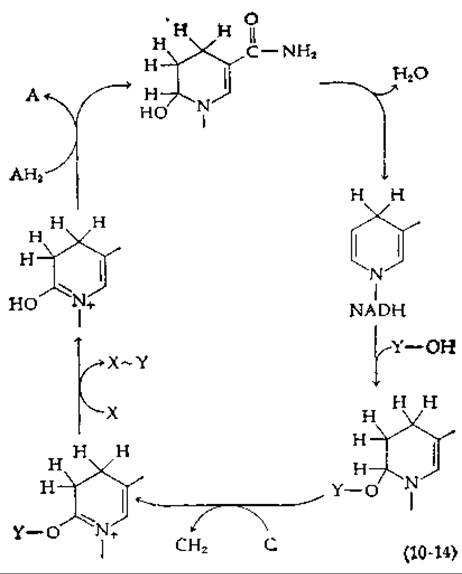
В одном из вариантов общей схемы Липмана постулируется нуклеофильное присоединение по двойной связи NADH [уравнение (8-48)]. Цикл окислительного фосфорилирования будет работать, как показано в уравнении (10-14) [85, 86]. Обратите внимание, что элиминирование молекулы воды для регенерации NADH является обращением реакции, представленной в уравнении (8-48); условия равновесия в этом случае оказываются неблагоприятными, что и является слабым местом схемы. Можно было бы рассмотреть также механизмы, основанные на присоединении Y—О- по 6-му положению NAD+2).
Многие исследователи задумывались над тем, нельзя ли привлечь для объяснения окислительного фосфорилирования особые химические свойства убихинона или других хинонов. Гаррисон [87] показал, что окисление фосфатного эфира гидрохинона (хинолфосфата) в подходящей модельной системе приводит к образованию высокоэнергетического окисленного промежуточного соединения. В присутствии Рі [X в уравнении (10-15)] образуется пирофосфат (X~Y). (В другом варианте Y может освобождаться в форме метафосфатной группы, способной к взаимодействию с X.) Неопределенным местом в уравнении (10-15) остается путь образования хинолфосфата. Как показано в уравнении, он может образовываться в результате присоединения YOH по карбонильной группе окисленного хиноина с последующей потерей Гидроксил-иона в ходе восстановления под действием АН2.
1) Различные механизмы, предложенные для окислительного фосфорилирования, перечислены в обзоре Ларди н Фергюсона |[82].
2) Читателю может быть интересно рассмотреть такую схему: Y—О- присоединяется по 6-му положению NAD+. Образовавшийся аддукт окисляется (из 6-го положения удаляется Н-). Новое производное переносит группу Y; при этом образуется Х~Y и остается 6-oкси-NAD+. Последний восстанавливается переносчиком АН2 в 6-окси-NADH, который после таутомеризации теряет ОН- и превращается в NAD+.

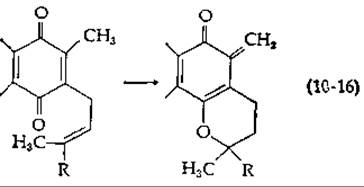
В модифицированной схеме [88] постулируется потеря протона метильной группой убихинна с одновременным замыканием кольца в хроманол с оргохиноноидиой структурой [хинонметид; уравнение (10-16)]. Присоединение фосфата и восстановление могут протекать в соответствии с уравнением (10-15) (внизу в центре и слева). Еще одна теория постулирует функционирование окисленной формы хинона в качестве восстановленного переносчика [89].
Уонг предложил схему фосфорилирования, основанную на особых химических свойствах цитохромов [уравнение (10-17)] [90, 91]. Восстановленная форма цитохрома с железом в Fe (II)-состоянии [уравнение (10-17), вверху справа] образует координационную связь с имидазольной группой белка. Далее в результате двухэлектронного окисления под действием переносчика происходит удаление одного электрона от железа, а другого от имидазольной группы и образуется радикал. Последний подвергается реакции сопряжения с Y. Затем в ходе двухэлектронного восстановления под действием АН2 промежуточный радикал и Fe(III) принимают электроны, образуя высокоэнергетическое производное восстановленной формы переносчика. Последнее Переносит Y на X.

Другая возможность основана на результатах окисления тиоэфиров иодом [91, 92]. Можно предположить участие в процессе остатков метионина, принадлежащих переносчику электронов и подвергающихся циклическому превращению. Имеются полные основания полагать, что в основе окислительного фосфорилирования могут лежать особые и пока плохо изученные химические свойства железо-серных митохондриальных белков.
б. Теории, основанные на конформационных изменениях белков
Прохождение электронов по цепи переносчиков может вызывать в белках конформационные изменения, которые могут приводить к синтезу высокоэнергетических промежуточных соединений. В пользу этого представления говорят хотя и малые, но отчетливо наблюдаемые конформационные изменения цитохрома с в ходе окисления и восстановления [12]. Тесная ассоциация одного белка с другим, характерная для внутренней митохондриальной мембраны, указывает на возможность передачи через один или несколько белков любого конформационного изменения, индуцированного на участке переноса электронов, на далеко отстоящий участок (например, на фактор сопряжения F1), где может происходить образование АТР.
При достаточно больших конформационных изменениях белка может произойти тесное сближение карбоксильной и SH-группы, приводящее к самопроизвольному образованию тиоэфирной связи. Затем, когда белок вновь примет ненапряженную конформацию, в полной мере сможет проявиться высокоэнергетический характер тиоэфирной связи, и она сможет вступить в обменные реакции, приводящие к синтезу АТР. Другой возможностью является связывание белком ADP и неорганического фосфата на близко расположенных участках. Тогда после соответствующих конформационных изменений эти два компонента могут быть буквально прижаты друг к другу с самопроизвольным удалением ОН-иона и образованием АТР и Н2О.
Очень интересная идея, возникающая из определенной группы экспериментальных данных [93], заключается в том, что ADP и Р, связываются на соседних участках и в гидрофобном окружении активного центра F1происходит самопроизвольное элиминирование молекулы Воды и образование прочно связанного с белком АТР. Движущей силой процесса может быть очень прочное связывание АТР с одним из конформеров белка. Перенос электронов может индуцировать конформационные изменения, вызывающие освобождение молекулой F1синтезированного АТР.
Идеи относительно конформационного сопряжения синтеза АТР и переноса электронов становятся еще более привлекательными, если мы вспомним, что АТР используется в мышцах для совершения механической работы. В этом случае гидролиз АТР сопряжен с относительным движением белковых компонентов мышцы (дополнение 10-Е). Не правомерно ли предположить, что образование АТР в свою очередь происходит в результате движения белковых компонентов, индуцированного в митохондриальной мембране? Весьма резкое изменение формы митохондрии, сопровождающее переход между состоянием 4 (недостаток ADP) и состоянием 3 (активное дыхание), навело некоторых исследователей на мысль о том, что фосфорилирование неразделимо связано с конформационными изменениями в мембранных белках [94]. Аналогичные рассуждения применимы к фосфорилированию в хлоропластах [95].
Существует также фононная теория, которая основана не на конформационных изменениях, а на особых решеточных колебаниях (например, валентных колебаний связей N—Н), возбуждаемых в мембранном белке при прохождении электронов [96]; эти колебания занимают диапазон частот 2700—5400 см-1, т. е. 32—65 кДж∙моль-1 (гл. 13, разд. Б, 3,а). В результате такого движения молекул белка подходящим образом расположенные фосфаты (возможно, связанные водородными связями с амидными группами главной цепи) могут соединяться вместе с образованием между ними пирофосфатной связи.
Дополнение 10-Е
Химия мышечного сокращения
В то время как свойства белковых ансамблей, обнаруженных в мышцах, описаны со многими интересными подробностями (гл. 4, разд. Е,1), остается открытым наиболее важный вопрос: каким образом мышечная машина использует свободную энергию гидролиза АТР для совершения механической работыа,б? На основании данных электронной микроскопии и дифракции рентгеновских лучей было установлено, что в состоянии окоченения все поперечные мостики, образуемые мнозиновыми головками, оказываются прочно прикрепленными к тонким нитям актина. Добавление же АТР приводит к мгновенному отсоединению мостиков от тонких нитей. В расслабленной мышце тонкие нити могут свободно двигаться на участках, прилегающих к толстым нитям, что придает мышце свойство слабо натянутой резиновой полоски. Однако активация мышцы под действием нервного импульса, сопровождаемая освобождением ионов кальция (гл. 4, разд. Е,1), заставляет тонкие нити скользить между толстыми, приводя в результате к укорочению мышцы.
Активированная мышца укорачивается лишь при сравнительно слабых нагрузках; при более высоких нагрузках она сохраняет постоянную длину. Поскольку максимальное напряжение мышцы оказывается пропорциональным длине участка, на котором перекрываются тонкие и толстые нити, то естественно приписать индивидуальным поперечным мостикам роль активных центров, генерирующих необходимое для сокращения мышцы усилие.

В широко принятой «гребной» модели («rowing hypothesis») Хаксли постулируются циклические изменения в состоянии поперечных мостиков. Как показано на прилагаемом рисункев, в исходном состоянии верхний конец миозинового стержня над «шарнирной областью», выступающей на 70—110 им из хвостовой части стержня, свободно перемещается в пространстве между толстыми и тонкими нитями. Добавленный АТР связывается с головками миозина, отсоединяя их от тонких нитей. Связанный АТР немедленно гидролизуется, но образовавшиеся в результате ADP и Pi остаются связанными в активном центре миозина. При этом часть свободной энергии гидролиза АТР запасается, возможно, в виде соответствующих конформационных изменений миозиновой головки. Пока отсутствуют ионы кальция, происходит лишь весьма медленное освобождение ADP и Рі с заменой на новый АТР. Таким образом, сам миозин обладает довольно слабой «АТРазной» активностью. Предполагается, что в активированной мышце головка, содержащая продукты расщепления АТР, соединяется с субъединицей актина поперечными мостиками, располагающимися под прямым углом к тонким нитям. Затем энергия, запасенная в миозиновой головке (или в актине), расходуется на осуществление конформационных изменений, в результате которых угол прикрепления миозиновой головки к тонкой нити изменяется с 90° примерно до 45°. Эти изменения можно наблюдать непосредственно с помощью электронной микроскопии. В отсутствие АТР (окоченение) головки образуют зубчатую структуру. связываясь с нитями актина под углом около 45°. Рассматриваемое изменение угла связывания считается достаточным для смещения нити актина на ~ 10 нм (длина двух актиновых субъединиц). Далее Рі и ADP освобождаются из области связывания с головкой; их замещает АТР, вызывающий диссоциацию актомиозинового комплекса. Тем временем другие поперечные мостики присоединяются к тонким нитям, препятствуя их возврату в первоначальное положение.
Модель Хаксли внушает достаточное уважение и достаточно хорошо обоснована экспериментально. Однако она не показывает, каким именно образом энергия гидролиза АТР связана с конформационными изменениями. Возможно, что в основе элементарного цикла мышечного сокращения лежат совершенно иные процессы. Выдвигалась также идея о том, что конформационные изменения происходят не в миозиновой головке и не в актине, а в «шарнирной» области миозина. В этой области имеется отрезок в 200—300 остатков, содержащий большое число положительно заряженных боковых цепей, и а-спираль, построенная из этих остатков, по-видимому, должна быть довольно неустойчивой. Возможно, взаимодействие с АТР вызывает кооперативное конформационное изменение в белке, в результате чего на упомянутом отрезке а-спираль превращается в «статистический клубок», в котором две пептидные цепи миозинового стержня имеют более вытянутую конформациюг,д. По-видимому, приток ионов кальция достаточен для дестабилизации структуры и конформационных изменений. Последующая реакция с актином должна вызывать обратные конформационные изменения, в результате чего отрезок цепи снова укорачивается и тянет за собой тонкую нить. Быть может, такого рода цикл, состоящий из обратимых растяжений и укорочений цепи, покажется читателю неубедительным, однако использование именно такого перехода «спираль — клубок» в коллагене позволило сконструировать интересный механизм, представленный на прилагаемом рисункее. Коллагеновый «шкив» проходит сначала через концентрированный раствор бромистого лития, где коллаген подвергается сокращению, а затем через воду, в которой проникшая в нить концентрированная соль разбавляется, вследствие чего спиральные цепи коллагена вновь приобретают конформацию статистического клубка. Эта машина действительно работает, используя в качестве источника энергии свободную энергию разбавления бромистого лития.

Интерес ряда исследователей направлен на то, чтобы выяснить, не заключены ли наиболее важные детали механизма мышечного сокращения в актинеж. Например, высказывалось предположение, что гидролиз АТР вызывает укорочение на несколько процентов сразу 15—20 молекул актина, что достаточно для общего перемещения на 10 нм, требуемого для сокращения. Согласно другой точке зрения, поперечные мостики не являются частью сократительного механизма, а служат лишь своего рода «защелками». Известно, что мышца сокращается, почти не меняя объема, и поэтому все, что вызывает утолщение саркомера, будет приводить к его сокращению. Высказывалось предположение, что после гидролиза АТР отрицательно заряженные фосфатные группы связываются с нитями актина и что возникающее при этом электростатическое отталкивание вызывает поперечное утолщение саркомераз. В ряде работ еще раз подчеркивалась возможность того, что энергия распада АТР трансформируется (резонансный переход) в энергию колебаний амидных связей в а-спиральных участках миозинаи,к. Эта колебательная энергия может передаваться на большие расстояния по имеющимся в белках сеткам водородных связей и каким-то образом используется в сократительном процессе. Хотя эта идея может показаться несколько искусственной, она напоминает нам, что миозиновые стержни, равно как и тонкие нити, нельзя представлять себе как инертный материал. Мы не знаем сейчас, в какой части системы находятся сократительные пружины; не исключено, что какая-то из умозрительных схем окажется правильной.
Читатель может и сам поразмыслить, какая механика нужна для того, чтобы расщепить АТР и произвести сокращение. При этом небесполезно взглянуть и на структуру самого АТР. Прежде всего обратите внимание на то, что трифосфатная группа содержит много отрицательных зарядов, взаимно отталкивающих друг друга. Представьте далее, что должно произойти, когда молекула АТР вытеснит ADP и Рі из связанной с актином миозиновой головки. При этом может нарушиться связь белок—белок; вероятнее всего в какой- то определенной точке на поверхности их контакта индуцируется электростатическое отталкивание. Подумайте об образовании АТР в процессе окислительного фосфорилирования и о возможной роли протонов в синтезе АТР (разд. Д, 9,в). Не могут ли протоны оказать какое-то влияние на белок, окружающий молекулу АТР, в обратном процессе? Подумайте о действии Mg2+, связанного в комплексе с полифосфатной группой АТР, а также о том, что может случиться, если с соседней группой белка свяжется ион Са2+. Примите во внимание данные о возможном фосфорилировании боковых цепей белка на промежуточных стадиях процесса. Что произойдет, если будет фосфорилирована боковая цепь гистидина, связанная водородной связью с пептидным остовом в концевом участке спирали? Автор этой книги не смог соединить все эти соображения в цельный механизм работы мышцы, но, может быть, кому-то из читателей удастся это сделать?
Хотя АТР служит непосредственным источником энергии работающей мышцы, его концентрация составляет лишь около 5 мМ. Однако в мышце, кроме того, содержится фосфаген, N-фосфатное производное гуанидинового соединения. В мышцах млекопитающих фосфагеном является креатинфосфат. У беспозвоночных такую роль играет аргининфосфат или родственные соединения.
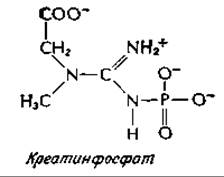
Потенциал переноса групп для креатинфосфата равен —43,1 кДж∙моль-1. Вследствие этого перенос с образованием АТР происходит самопроизвольно, со значением ∆G' = —8,6 кДж∙моль-1. Креатинфосфат находится в мышце в концентрации 20 мМ, играя роль резервуара высокоэнергетических фосфорильных групп и поддерживая в адениловой системе мышцы высокий уровень «энергетического заряда» (биосинтез креатина описан в гл. 14, разд. В,3).
а Tonomura Y., Oosawa F., Annu. Rev. Biophysics Bioeng., 1, 159—190
б Taylor E. W., Annu. Rev. Biochem., 41, 577—616 (1972).
в Рисунок заимствован из статьи Mannherz Н. G., Leigh I. В., Holmes К. С., Rosenbaum G., Nature (London), New Biol., 241, 226—229 (1973).
г Harrington W. F., PNAS, 68, 685—689 (1971).
д Burke M., Himmelfarb S., Harrington W. F., Biochemistry, 12, 701—710 (1973).
e Steinberg I. Z., Opłatka A., Katchalsky A., Nature (London), 210, 568— 571 (1966).
ж Laid К., J. Theor. Biol., 44, 117—130 (1974).
з Ashley R., J. Theor. Biol., 36, 339—354 (1972).
и McClare C. W. F., J. Theor. Biol., 35, 569—595 (1972).
к Davydov A. S., J. Theor. Biol., 38, 559—569 (1973).
в. Теории, основанные на протонном градиенте
Принимая во внимание отрицательный итог всех попыток найти высокоэнергетические промежуточные соединения, а также очевидную необходимость интактной мембраны, Митчелл в 1961 г. предложил химио-осмотическую теорию окислительного фосфорилирования [97, 98]. В этой теории также принимается в расчет наличие энергозависимых процессов, таких, как накопление митохондриями катионов. Принципиальные положения теории Митчелла проиллюстрированы на рис. 10-12. Предполагается, что во внутренней мембране митохондрии имеется протонный насос, приводимый в действие потоком электронов: этот насос выкачивает протоны из матрикса через мембрану. Идея о выкачивании протонов путем переноса электронов сама по себе не нова; еще ранее высказывалось предположение, что этот механизм лежит в основе накопления в желудке соляной кислоты. Как указано на рис. 10-12, окисленный переносчик В при восстановлении в форму ВН2 приобретает два протона. Эти протоны не обязательно должны поступать от восстановленного переносчика АН2, и Митчелл предположил, что они захватываются из раствора на внутренней стороне мембраны, т. е. со стороны матрикса. Затем, когда ВН2 вновь окисляется под действием переносчика С, протоны освобождаются, но уже с наружной стороны мембраны. Митчелл привел данные, свидетельствующие о наличии требуемой стехиометрии процесса: на каждые два протона, прошедшие через мембрану, синтезируется одна молекула АТР. Отсюда следует, что в цепь переноса электронов должно быть встроено три разных протонных насоса, соответствующих трем участкам фосфорилирования.
Постулированные протонные насосы должны приводить либо к накоплению значительного избытка протонов в межмембранном пространстве с вытекающим отсюда понижением pH, либо к накоплению протонов на самой мембране. Второй вариант должен соответствовать случаю, когда через мембрану вместе с протонами не проходят противоионы X-. В результате генерируется мембранный потенциал — явление, надежно установленное для мембран нервных клеток (гл. 5, разд. Б,3).
Согласно главному постулату химио-осмотической теории, в мембране имеется ориентированная АТРаза или АТР-синтетаза, которая использует свободную энергию протонного градиента для синтеза АТР (рис. 10-12). Учитывая, что ∆G' (pH 7) для синтеза АТР составляет + 34,5 кДж∙моль-1, и полагая, что для образования одной молекулы АТР требуется прохождение через АТРазу двух протонов, можно подсчитать, что необходимый градиент pH [уравнение (3-25)] будет равен 34,5/(2∙5,708) = 3,0 ед. pH при 25 °С. Однако при степени фосфорилирования —104 М-1 градиент pH должен составить —5 ед. Экспериментальным путем было показано, что прохождение электронов действительно индуцирует разницу в pH и что искусственно индуцированный градиент pH (на разных сторонах митохондриальной мембраны) приводит к синтезу АТР. Однако требуемого порядка величин в градиентах pH не наблюдалось. Вместе с тем, если мембрана заряжена так, как указано на рис. 10-12, без накопления избытка протонов в среде, то на мембране возникает потенциал, который может быть использован для синтеза АТР так же, как и протонный градиент. Градиенту pH в 3,0 ед. при 25 °С будет эквивалентен мембранный потенциал ∆ψ ∼0,177 В [уравнение (3-63)]. Изменение свободной энергии при прохождении сквозь мембрану одного иона выражается уравнением
![]()
Суммарный эффект градиента pH и мембранного потенциала (оба показателя выражают в вольтах) называют протонодвижущей силой, описываемой следующим уравнением:
![]()
где RT/F = 0,0592 при 25 °С. Поскольку мембранный потенциал как митохондрий, так и хлоропластов непосредственно измерить очень трудно, этот постулат не прошел необходимой проверки1). Тем не менее гипотеза Митчелла стимулировала постановку множества экспериментов и обычно рассматривается как одна из наиболее важных существующих на сегодня концепций мембранной биологии.
Как же теперь объяснить накопление ионов митохондриями? Как показано в нижней части рис. 10-12, электронейтральность можно сохранять двумя способами. Перенесенные на наружную сторону протоны можно уравновесить параллельным потоком противоионов X-. С другой стороны, если на каждые два протона, проходящие наружу, проникает внутрь такой катион, как Са2+, то нейтральность тоже будет сохранена, но в митохондриях при этом должно наблюдаться накопление ионов Са2+. Экспериментально было показано, что перенос электронов действительно сопровождается накоплением катионов. Накапливаются не только ионы кальция; в присутствии подходящего ионофора (гл. 5, разд. Б, 2,в) может наблюдаться «энергозависимое» накопление ионов калия [99].
Можно ли хотя бы мысленно представить конструкцию протонного насоса и ориентированной АТРазы, приводимой в действие потоком электронов? Мы рассмотрим только одну чисто гипотетическую модель. Чтобы нуклеофил Y мог образовать богатую энергией связь Y~P прямой атакой атома фосфора Pi, необходимо удалить ион ОН-. При pH 7 вероятность такой реакции очень мала, но она может стать заметной при более низких pH. Таким образом, мы можем себе представить, что функция ориентированной АТРазы состоит в том, чтобы захватывать протон и специфически удерживать его вблизи атома кислорода, который должен быть элиминирован [уравнение (10-20)]. А как можно направить протон в точно нужное место? Вероятно, он мог бы проходить по каналу в мембране, который и доставляет его в требуемый участок. Пожалуй, еще легче себе представить, что протон специфически генерируется в нужном месте непосредственно в процессе переноса электронов.
1) Мембранный потенциал оценивается косвенным образом, например исходя из распределения ионов К+ на разных сторонах митохондриальных мембран в присутствии валииомицииа [98a] или с помощью красителей, меняющих флуоресценцию в зависимости от мембранного потенциала [98b]. Исследовались и мембранные пузырьки клеток Е. coli [98с], но интерпретация результатов остается противоречивой [98d].
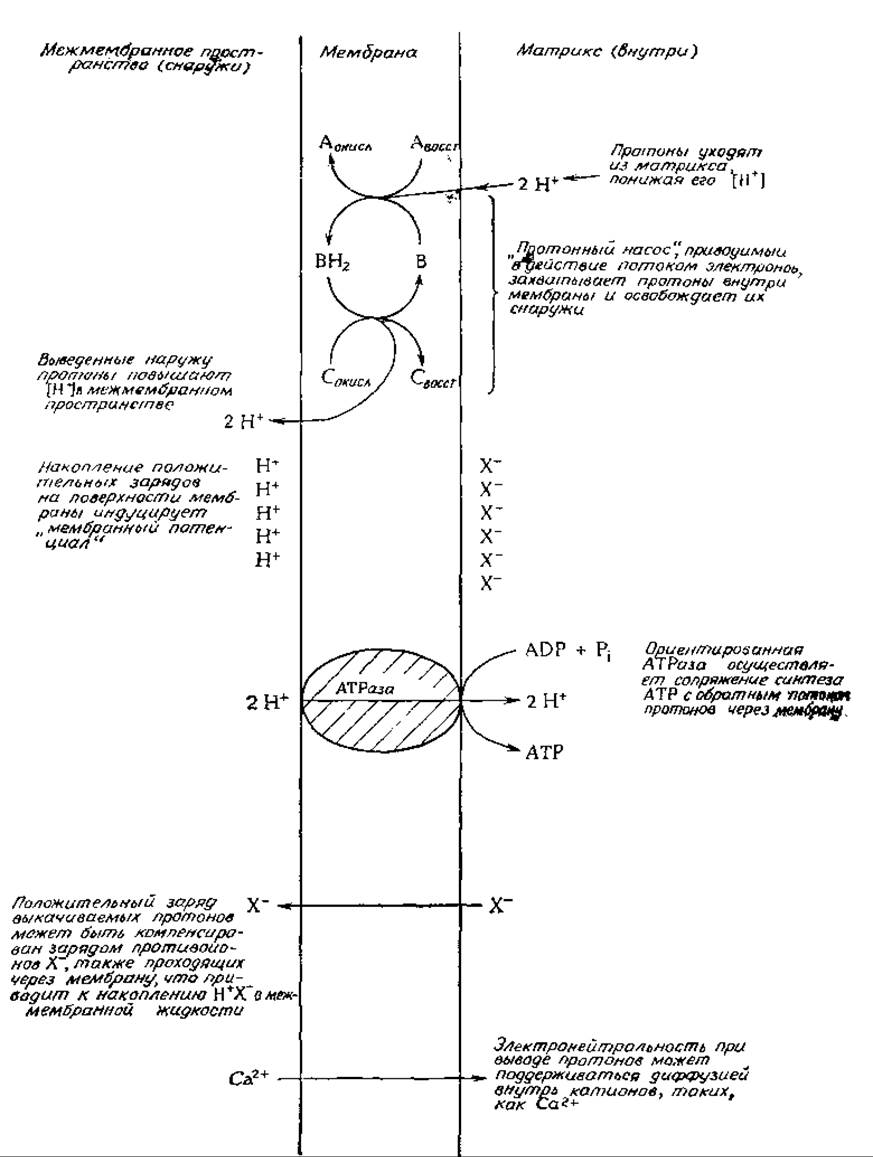
РИС. 30-32 Принципиальные черты химио-осмотической теории окислительного фосфорилирования.
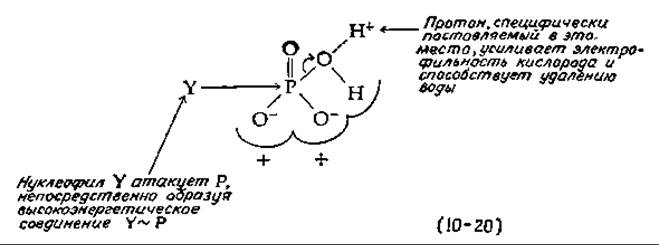
Теперь подумаем, к чему приведет окисление атома железа в цитохроме из Fe2+ в Fe3+. Вполне естественно представить, что удаление электрона вызовет цепь электронных перемещений в координационно связанном гистидине, в примыкающем к нему пептиде и в других полярных группах [уравнение (10-21)], вследствие чего около фосфата появится лишний протон.

Можно представить себе, что эта цепь перестроек дойдет до соседнего белка и достигнет активного центра белка Ft. Тем самым мы совершили полный круг и опять начинаем искать нечто вроде «высокоэнергетического промежуточного соединения». У многих биохимиков есть такое ощущение, что, когда окислительное фосфорилирование получит полное объяснение, окажется, что доля истины была во всех имеющихся на сегодня и конкурирующих между собой воззрениях.