Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
О том, как электроны встречаются с кислородом, как при этом образуется ATR и о некоторых родственных явлениях
Цепь переноса электронов и окислительное фосфорилирование
Транспорт через митохондриальные мембраны
Как и наружная плазматическая клеточная мембрана, внутренняя митохондриальная мембрана отличается высокой избирательностью. Некоторые неионизированные вещества легко проходят через нее, тогда как транспорт ионных веществ, включая анионы дикарбоновых и трикарбоновых кислот, находится под жестким контролем. В некоторых случаях анионы перемещаются в результате энергозависимого «активного транспорта». В других случаях анион может пройти внутрь лишь в обмен на другой анион, выходящий наружу. Во всех этих случаях необходимо участие специфических транслоцирующих белков-переносчиков (гл. 5, разд, Б,2).
Одна из систем транслокации производит обмен ADP на АТР. Этот адениннуклеотидный переносчик поставляет ADP в матрикс, где он подвергается фосфорилированию, и в отношении 1:1 переносит АТР в цитоплазму [60, 100—102]. Отдельный переносчик ведает доставкой Pi, вероятно, в форме Н2РО-4. Обычно полагают, что степень фосфорилирования Rp = [ATP]/[ADP] ∙ [Pi] имеет одно и то же значение снаружи и внутри митохондрии. Однако Клингенберг установил, что Rp снаружи в 10 раз больше, чем внутри [102]. Это должно означать, что вновь синтезированный АТР освобождается преимущественно снаружи внутренней митохондриальной мембраны. Меньшая часть АТР должна освобождаться внутри митохондрии, где она затрачивается на активацию жирных кислот, синтез белков и т. д. Пируват, по-видимому, тоже попадает в митохондрию с помощью собственного переносчика — по всей вероятности, вместе с протоном. С другой стороны, анионы дикарбоновых кислот, например малат или а-кетоглутарат, обмениваются в отношении 1:1, равно как и аспартат, и глутамат.
Мембраны митохондрий непроницаемы для NADH. Таким образом, перенос в митохондрии восстанавливающих эквивалентов от NADH, образующегося в цитоплазме, составляет важную проблему. В грибах и зеленых растениях она решается присутствием двух NADH-дегидрогеназ (флавопротеидов), встроенных во внутреннюю митохондриальную мембрану [61, 103]. Одна обращена к матриксу и окисляет эндогенный NADH, образовавшийся в матриксе, а другая обращена наружу, в межмембранное пространство, и окисляет экзогенный NADH, образовавшийся в цитоплазме. Оба фермента передают электроны в цепь переносчиков через убихинон, однако экзогенную NADH-дегидрогеназу ротенон не ингибирует (рис. 10-11).
У животных восстанавливающие эквиваленты NADH поступают в митохондрии косвенным путем. Было постулировано много различных механизмов, и весьма возможно, что в действительности реализуется несколько механизмов одновременно. В летательной мышце насекомых NADH восстанавливает диоксиацетонфосфат. Образовавшийся в результате а-глицерофосфат (sn-3-глицерофосфат) проходит через проницаемую наружную мембрану митохондрии, после чего он снова окисляется в диоксиацетонфосфат с помощью FAD-содержащей глицерофосфатдегидрогеназы, встроенной в наружную поверхность внутренней мембраны. Диоксиацетон может вернуться обратно в цитоплазму. Такой глицерофосфатный челночный механизм (рис. 10-13) в конечном итоге обеспечивает митохондриальное окисление NADH, образовавшегося в цитоплазме. У млекопитающих аналогичную функцию, по-видимому, выполняет более сложный малат-аспартатный челночный механизм (рис. 10-13). В этом случае перенос восстанавливающих эквивалентов в митохондрию включает восстановление оксалоацетата в малат под действием NADH, перенос малата в митохондрию и его реокисление с помощью NAD+. Однако митохондриальные мембраны очень мало проницаемы для оксалоацетата. Поэтому возврат последнего в цитоплазму происходит через его переаминирование в аспартат, который уходит из митохондрии вместе с а-кетоглутаратом. Одновременно в обмен на аспартат в митохондрию поступает глутамат. а-Кетоглутарат предположительно выходит наружу в обмен на поступающий внутрь малат, как указано на рис. 10-13.
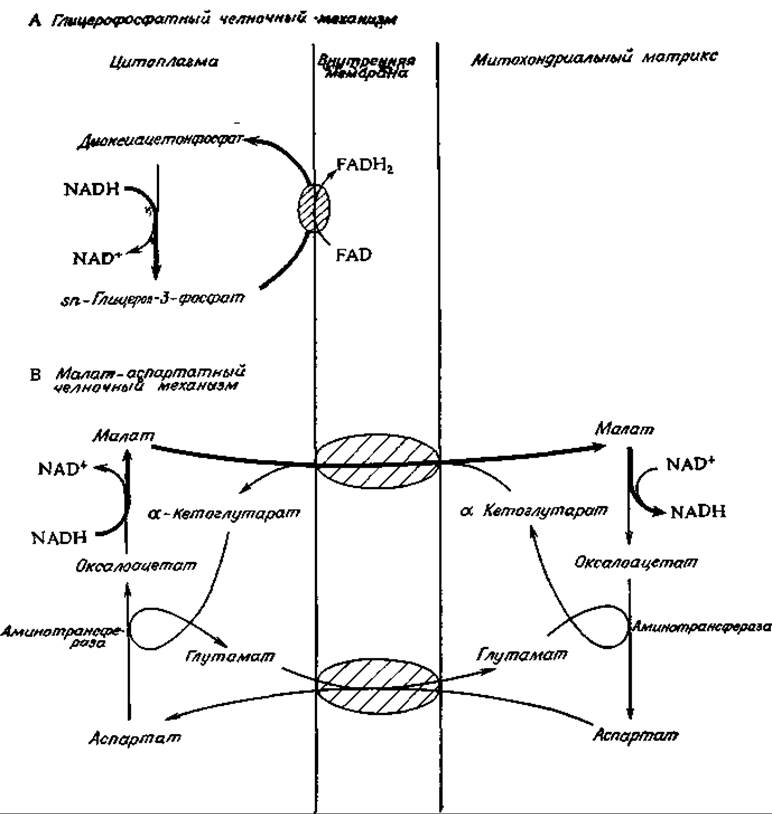
РИС. 10-13. Глицерофосфатиый (А) и малат-аспартатный (Б) и челночные механизмы, обеспечивающие перенос электронов от цитоплазматического NADH в митохондрии. Жирными стрелками указан путь переносимых электронов.
Существует предположение, что вывод аспартата из митохондрии связан с потреблением энергии; в этом случае можно провести аналогию с работой Na+-Hacoca в цитоплазматической мембране [104]. Механизм такого транспорта может быть сходен по характеру с механизмом поглощения аминокислот цитоплазматическими мембранными пузырьками бактерий [105—107]. Накопление аминокислот такими Пузырьками, по-видимому, не зависит от АТР, но сопряжено с переносом электронов, осуществляемым специфическими, связанными с мембраной флавинсодержащими дегидрогеназами. Поглощению аминокислот пузырьками Е. coli особенно эффективно содействует дегидрирование D-лактата. Отщепление водородов от L-лактата или глицерофосфата способствует всасыванию аминокислот пузырьками Staphylococcus aureus. Сродство аминокислоты к мембранным «насосам» таких пузырьков, по всей вероятности, зависит от окислительно-восстановительного состояния переносчиков электронов, находящихся в мембране. Эти результаты позволяют думать, что «насос» содержит белок, в который встраивается переносчик; окислительно-восстановительное состояние переносчика регулирует сродство к субстрату и одновременно индуцирует конформационные изменения. Например, могут происходить изменения, аналогичные тем, какие индуцируются фосфорилированием и дефосфорилированием в гипотетическом Na+-нacoсе, изображенном на рис. 5-3. Вместе с тем интерпретация экспериментальных данных, лежащих в основе этих предположений, пока остается спорной [107, 108].
Роль карнитина, ускоряющего транспорт жирных кислот внутрь митохондрий, уже рассматривалась в гл. 9, разд. А,6.