Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Ферменты: белковые катализаторы клеток
Специфичность действия ферментов
Комплементарность поверхностей субстрата и фермента
Поразительная специфичность действия ферментов привела к созданию теории замка и ключа, согласно которой для протекания реакции необходимо точное структурное соответствие между субстратом и активным центром фермента. Проведенные эксперименты убедительно доказали адекватность этой идеи, однако сама теория претерпела существенное изменение. Считается, что если фермент — это «замок», а субстрат — «ключ», то введение ключа в замок часто индуцирует конформационные изменения в молекуле белка. Имеется множество работ, в которых показано, что фермент «укладывается» вокруг субстрата, обеспечивая более точное соответствие подгоняемых структур. В пользу этого говорят данные по изменению спектров кругового дихроизма, спектров поглощения в УФ-области и констант седиментации, а также результаты исследования структуры комплексов ферментов с ингибиторами методом рентгеноструктурного анализа. Как мы уже видели ранее (гл. 4, разд. Д, I), идея «индуцированного соответствия» оказывается весьма плодотворной и при обсуждении взаимодействий субъединиц.
Какова структура активных центров? Благодаря кристаллографическим исследованиям мы можем непосредственно «увидеть», как устроено все большее и большее их число. Однако рентгеноструктурный анализ обычно не позволяет получить четкого представления о конформационных изменениях, обеспечивающих индуцированное соответствие. Кроме того, кристаллографические исследования с высоким разрешением проведены лишь для относительно небольшого числа ферментов. Поэтому для выяснения структуры активного центра энзимологии продолжают широко использовать традиционные химические методы «картирования», измеряя константы связывания ингибиторов, структуру которых последовательно изменяют, и исследуя, как влияют изменения структуры субстратов на связывание и скорость реакции. Хорошим примером исследования такого рода может служить работа Мейстера (Meister) и его сотрудников, исследовавших глутаминсинтетазу из мозга овцы. Субстратами фермента являются как D- и L-глутаминовая кислоты, так и a-аминоадипиновая кислота. В то же время из десяти монометильных производных D- и L-глутаминовой кислот субстратами глутаминсинтетазы могут служить только три. Если допустить, что субстраты связываются в полностью вытянутой конформации, то все атомы водорода, замена которых не приводит к исчезновению активности, лежат с одной стороны остова молекулы (за плоскостью рисунка на следующих двух схемах):
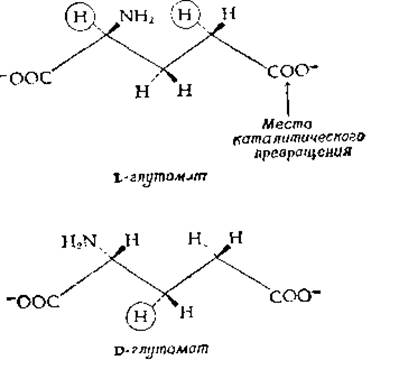
При замене атомов водорода, заключенных на схемах в кружки, способность соединения служить субстратом для глутаминсинтетазы сохраняется. Это означает, что к ферменту обращена та сторона молекулы, которая на схемах направлена к читателю. Опираясь на эту гипотезу, Гасс и Мейстер [43] синтезировали дикарбоксициклогексановый аналог L-глутамата (L-цис-1-амино-1,3-дикарбоксициклогексан):
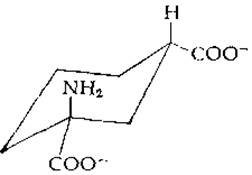
В этом аналоге циклогексановое кольцо замыкало точки, в которых находились оба заменяемые атомы водорода. Синтезированное соединение оказалось хорошим субстратом для глутаминсинтетазы, что подтверждало выдвинутую авторами гипотезу. Кроме тою, эти данные позволили получить конкретные сведения о геометрии связывающего центра фермента.