Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Биосинтез; как образуются новые молекулы
Регуляция процессов биосинтеза
Гликоген и глюкоза крови
Метаболизм глюкозы у животных имеет две наиболее важные особенности [44]. Первая из них — это запасание гликогена, который в случае необходимости может быть быстро использован в качестве источника мышечной энергии. Однако скорость гликолиза может оказаться высокой — весь запас гликогена в мышце может быть истощен всего лишь за 20 с при анаэробном брожении или за 3,5 мин в случае окислительного метаболизма [45]. Таким образом, должен существовать способ быстрого включения гликолиза и его выключения после того, как необходимость в нем исчезнет. В то же время должна иметься возможность обратного превращения лактата в глюкозу или в гликоген (глюконеогенез). Запас глюкогена, содержащегося в мышцах, должен пополняться за счет глюкозы крови. Если количество глюкозы, поступающей с пищей или извлекаемой из гликогена печени, оказывается недостаточным, то она должна синтезироваться из аминокислот.
Вторая особенность метаболизма глюкозы состоит в том, что определенные ткани, в том числе мозг, клетки крови, мозговое вещество почек и семенники, получают практически всю необходимую для них энергию за счет окисления глюкозы. Поэтому нельзя допускать, чтобы содержание глюкозы в крови падало значительно ниже нормы (5 мМ).
Механизм регуляции содержания глюкозы в крови очень сложен и окончательно не установлен. Известно, что в нем участвует ряд гормонов.
Инсулин (гл. 4, разд. 9,7; гл. 5, разд. В, 5, дополнение H-В), вероятно, в комбинации с хромом (дополнение 11-Г) повышает скорость усвоения глюкозы мышцами и другими тканями. Глюкагон (гл 6, разд. Е, 5) — пептидный гормон, состоящий из 29 аминокислотных остатков, действует в первую очередь на клетки печени. Глюкагон выделяется а-клетками островков Лангерганса поджелудочной железы, т. е. теми же клетками, которые продуцируют инсулин. Однако действие глюкагона антагонистично действию инсулина, поскольку он повышает содержание глюкозы в крови, стимулируя расщепление гликогена печени. Он стимулирует также процесс глюконеогенеза, причем оба эти эффекта опосредованы действием циклической АМР [46]. Глюкокортикоиды (гл. 12, разд. И, 3,6) ускоряют процесс глюконеогенеза и накопление глигогена в печени при помощи механизмов, рассмотренных в разд. Е, 7.
Дополнение 11-В
Сахарный диабет
Хорошо известным и широко распространенным метаболическим нарушением у человека является диабет. Из одного миллиона детей в возрасте от 8 до 12 лет 400 страдают юношеской формой диабета. Приблизительно 33 000 человек в возрасте от 40 до 50 лет из каждого миллиона (т. е. более 3%) больны диабетом, а среди лиц старше 70 лет, этим заболеванием страдают более 7%а. Склонность к диабету отчасти передается по наследству; значительную часть генетической популяции составляют по меньшей мере два рецессивных «дефектных» гена. Степень тяжести диабета варьирует в весьма широких пределах. Около половины больных юношей может ограничиться диетой, тогда как другая половина вынуждена прибегать к инъекциям инсулина из-за атрофии ß-клеток поджелудочной железы, продуцирующих инсулин. Среди взрослых больных диабетом часто возникает проблема снижения чувствительности больного к вводимому инсулинуб. Пониженная чувствительность может быть обусловлена либо недостаточным числом рецепторов инсулина, либо дефектами их структуры. Пониженное число рецепторов наблюдалось также у устойчивых к инсулину тучных пациентов. Лечение многих больных диабетом сульфопрепаратами, и в частности 1-бутил-n-толилсульфонилмочевиной:
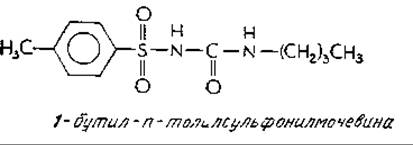
в ряде случаев приводило к повышению числа рецепторов инсулина. Строгая диета оказывает аналогичное действие. У некоторых пациентов была обнаружена повышенная активность ферментов, обусловливающих расщепление инсулина. При диабете обычно наблюдается повышенный синтез глюкагона, и, возможно, этот факт облегчит решение некоторых проблем, связанных с этой болезньюб.
Интерес в последнее время привлекает также другой пептидный гормон, а именно соматостатин (гл. 16, разд. А, 1), который ингибирует процесс высвобождения глюкагона и инсулина из клеток поджелудочной железы. Состояние некоторых больных, страдающих диабетом при введении этого гормона, улучшается.
Четким симптомом диабета служит высокая концентрация глюкозы в крови, содержание которой может достигать 8—60 мМв. Очевидно, что прекращение процесса использования глюкозы вызвано выходом глюкозы из-под контроля, осуществляемого по принципу обратной связи. В результате процесс глюконеогенеза становится более интенсивным, что в свою очередь приводит к усиленному расщеплению белков и аминокислот. Запасы гликогена в печени истощаются, и в моче обнаруживается избыток азота, образующегося в результате распада белков. Накопление продуктов расщепления жирных кислот приводит к избыточному образованию кетоновых тел (стр. 515), а увеличение объема мочи сопровождается обезвоживанием тканей.
Несмотря на большое число исследований, чисто химический аспект действия инсулина остается неяснымг,д. Обычно считается, что гормон действует на плазматические мембраны всех тканей, вызывая заметные изменения проницаемости, что приводит к возрастанию поглощения глюкозы, различных ионов и других веществ. Такого рода изменения проницаемости могут обусловить сильное влияние инсулина на важнейшие процессы биосинтеза: имеет место, в частности, повышение синтеза гликогена, липидов и белков. В то же время процессы катаболизма подавляются и активность катаболических ферментов, например глюкозо-6-фосфатазы, снижается. Ключом к пониманию действия инсулина может явиться выяснение вопроса о природе его «вторичного посредника», аналогичного по своему действию сАМР. Высказывались предположения, что «вторичным посредником» для инсулина является сАМР, однако более вероятно, что эту роль выполняет какой-то ион, возможно К+е.
Полный химический синтез инсулина был осуществлен в ряде лабораторий, причем наиболее трудной частью этого синтеза оказалось образование дисульфидных мостиков в требуемых местах молекулы. Для решения этой задачи были предприняты попытки «подражательного» характера, в которых образование поперечных мостиков производилось не в инсулине, а в проинсулине (рис. 11-9). Необходимость в синтетическом инсулине обусловлена не только тем, что его получение из животных не может удовлетворить огромной потребности людей в этом гормоне, но также и тем, что химический синтез позволяет получать инсулин с любой первичной структурой, и в частности со структурой, отличной от структуры инсулина, выделяемого из животных, что может оказаться крайне важным и полезным для определенных групп больных диабетом.
a Apgar V., Beck Is My Baby Allright? Trident Press, New York, 1972.
б Maugh T. H., II, Science, 193, 220—222 and 252 (1976).
в Для легких форм диабета более характерно нижнее из приведенных значений, поскольку, если концентрация глюкозы превышает почечный порог (~8 мМ), избыток выводится с мочой.
г White A., Handler Р., Smith Е. L., Principles of Biochemistry, 5th ed., pp. 1094—1101, McGraw-Hill, New York, 1973.
д См. t. 1, (стр. 291 и 386) н стр. 507 данного тома, где приведены сведения о структуре инсулина, рецепторах на клеточной поверхности и «усилении» ионами хрома.
е Hers Н. G., Annu. Rev. Biochem., 45, 167—189 (1976).
ж Anonymous, Chem. and Eng. News, 52 (April 29), 19—22 (1974).
Дополнение 11-Г
Микроэлементы: хром
В 1959 г. было установлено, что животные, в пище которых нехватает хрома, плохо растут и живут недолго. Для таких животных характерна также пониженная «толерантность к глюкозе», выражающаяся в том, что глюкоза, вводимая в кровь, выделяется в два раза медленнее, чем в нормеа,б,в. Это состояние по существу не отличается от состояния, вызванного нехваткой инсулина. При фракционировании дрожжей удается выделить хромсодержащий фактор толерантности к глюкозе, который представляет собой комплекс, содержащий ионы Сr3+, никотиновую кислоту и аминокислотыг. Есть основания считать, что хром, содержащийся в факторе толерантности к глюкозе, реагирует с инсулином и каким-то образом усиливает его действиед,е. В соответствии с этим предположением находится тот факт, что обычное содержание хрома в сыворотке крови, которое составляет приблизительно 0,03 мМ, резко снижается при введении в кровь глюкозыж. Это свидетельствует о том, что хром активно используется в процессе углеводного метаболизма, осуществляя, по-видимому, связывание инсулина с рецепторами клеточных мембран. Уменьшение содержания хрома в сыворотке крови при острых инфекциях (несмотря на увеличение содержания инсулина) указывает на то, что метаболизм хрома у человека заслуживает пристального внимания.
Концентрация хрома в тканях животных не превышает обычно 2 мМ, однако в хвостатых ядрах мозга его содержание значительно выше. Высокие концентрации ионов Сr3+ были обнаружены также в комплексах РНК — белокp.
Представляет интерес экспериментальное использование хрома при образовании комплексов Сr(III) с нуклеотидами, например с АТРи. Хром вытесняет ионы магния, образуя с нуклеотидами очень прочные хелатные комплексы. Характерные для таких комплексов полосы поглощения света и парамагнитные свойства ядер хрома делают эти комплексы интересным «орудием» при исследовании механизмов действия фосфотрансфераз.
Недавно образование «необменоспособных» комплексов с Сr(III) или с Со(III) было использовано в качестве метода выявления участков в белках и в других биополимерах, активно связывающихся с металламик,л,м. Двухвалентные ионы, связанные с такими участками, например Mg2+ или Zn2+, сначала замещаются ионами Со2+ или Сr2+, после чего эти ионы окисляются (чаще всего при помощи Н2О2) до трехвалентного состояния. Taкoе превращение легко происходит только в тех случаях, когда активные участки обладают октаэдрической геометрией. Трехвалентные ионы Со или Сr прочно связываются с окружающими его лигандами, в результате чего появляется возможность выщеплять значительную часть макромолекулы, сохраняя при этом небольшой ее фрагмент, прочно связанный с металлом.
а Mertz W., Fed. Proc. Fed. Am. Soc. Exp. Biol., 26, 186—193 (1967).
б Mertz W., Cornatzer W. E., Newer Trace Elements in Nutrition, Dekker, New York, 1971.
в Frieden E., Sсi. Am., 227, 52—60 (July 1972).
г Mertz W., Fed. Proc., Fed Am. Soc. Exp Biol., 33, 659 (1974).
д Evans G. W., Roginski E. E., Mertz W., Fed. Proc., 31, 264 (Abstr.), (1972).
e Roginski E. E., Fed. Proc., Fed. Am. Soc. Exp. Biol., 33, 659 (1974).
ж Pekarek R. S., Hauer E. C., Rayfield E. J., Wannemacher R. W., Jr., Beisei W. R., Fed. Proc., Fed. Am. Soc. Exp. Biol., 33, 660 (1974).
з O'Dell B. L., Campbell B. J., Compr. Biochem, 21, 179—266 (1971).
и DePamphills M. L., Cleland W. W., Biochemistry, 12, 3714—3724 (1973).
к Anderson R. A., Vallee B. L., PNAS, 72, 394—397 (1975).
л Wright J. К., Feldman J., Takahashi M., Biochemistry, 15, 3704—3710 (1976).
м Rose S. L., Westhead E. W., Abstr., 172nd ACS Natl. Meet. San Francisco, 1976, BIOL., p. 34.