Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Биосинтез; как образуются новые молекулы
Полипренильные (изопреноидные) соединения
Пренильная группа изопентенилпирофосфата служит прямым предшественником в биосинтезе терпенов, каротиноидов и стероидов (рис. 12-11) [75—78]. Образование этой пятиуглеродной разветвленной структуры обсуждалось уже ранее (гл. 11, разд. Г, 10; рис. 11-8) и схематически изображено на рис. 12-11. Один из этапов синтеза мевалоновой кислоты, а именно двухступенчатое восстановление 3-окси-3-метилглутарил-СоА, является строго регулируемой реакцией. Предполагается, что у человека скорость этой реакции в печени определяет интенсивность биосинтеза холестерина [44, 79]. Активность фермента снижается по принципу обратной связи при накоплении холестерина или его метаболитов.
Образованию полипренильных соединений предшествует изомеризация изопентенилпирофосфата в диметилаллилпирофосфат [рис. 12-11; уравнение (7-84)]. В ходе этого процесса происходит потеря водорода, находившегося в 4-про-5-положении в мевалоновой кислоте (про-R-пoложение в изопентенилпирофосфате). Диметилаллилпирофосфат служит исходной структурной единицей, к которой присоединяются дополнительные пренильные остатки, причем этот процесс сопровождается отщеплением пирофосфата (рис. 12-11). В каждой из реакций присоединения пренильного остатка водород, расположенный в мевалоновой кислоте в 4-про-5-положении, отщепляется в виде прогона [44, 76—78].
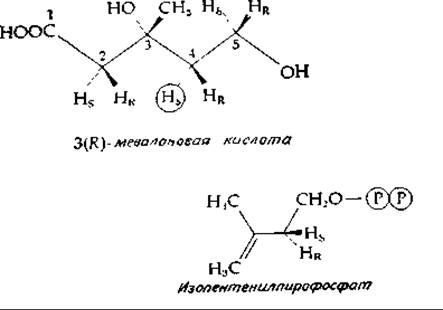
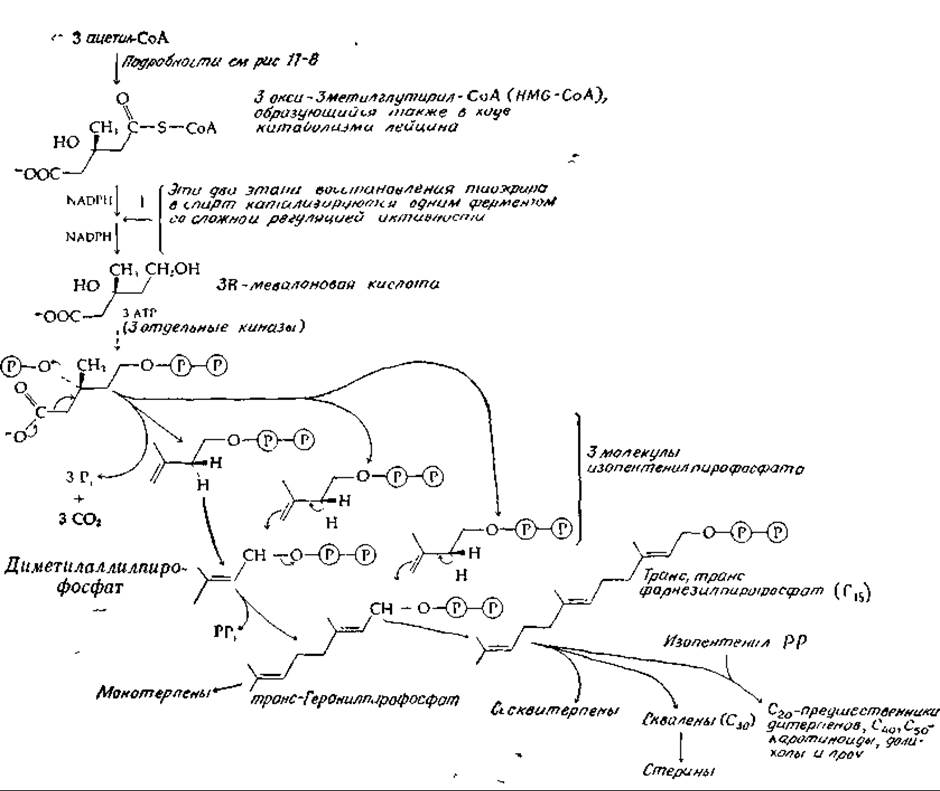
РИС. 12-11. Биосинтез полипреннловых соединений.
Полимеризация пренильных остатков может приводить к образованию высокополимерных полипренильных спиртов, таких, как долихолы (разд. В, 3), или высокополимерного каучука. Следует отметить, что в последнем случае формируются практически только цис-двойные связи, тогда как большинство полипренильных соединений содержит в основном транс-двойные связи. Указанному наблюдению соответствует тот факт, что при синтезе каучука происходит отщепление от мевалоновой кислоты протона в положении пpo-R (но не в положении про-S).
Завершение процесса удлинения цепи при полимеризации пренильных остатков протекает различными путями. Один из них — гидролиз пирофосфатной группы с образованием монофосфата или свободного спирта. Другой путь — это соединение двух полипренильных производных по схеме «голова-к-голове», в результате чего формируется симметричный димер. Таким способом происходит образование 30-углеродного терпена сквалена — предшественника холестерина, а также фитоена — предшественника С40-каротиноидов.
Дополнение 12-Б
Как образуются краски цветов
Пигменты цветов образуются из своеобразного поликетидного предшественника. Фенилаланин превращается в транс- коричную кислоту [уравнение (8-36)] и ее СоА-производное (циннамоил-СоА). Это производное используется в качестве предшественника в последующем биосинтезе. Прежде всего происходит удлинение цепи при участии малонил-СоА (этап а в прилагаемой схеме). Образующийся при этом ß-поликетон может циклизоваться по одному из двух путей: альдольная конденсация (этап б) приводит к синтезу стильбенкарбоновой кислоты и далее таких соединений, как 3,5-диоксистильбен хвойных деревьев; в результате конденсации Клайзена (этап в) возникают халконы, флавоны и флавононы. Они в свою очередь превращаются в желтые пигменты флавонолы и красные, пурпурные и синие антоцианидиныа,б.
В нижней части схемы биосинтеза пигментов приведены структуры и названия трех широко распространенных антоцианидинов. Наименование пигмента обычно является производным названия цветка, из которого пигмент был выделен. Цвет пигмента зависит от количества гидроксильных групп и наличия или отсутствия метальных или гликозильных остатков. Помимо трех пигментов, приведенных на схеме, назовем еще три распространенных антоцианидина, образующихся путем метилирования: пеонидин, являющийся 3-метилцианидином; петунидин, образующийся при метилировании дельфинидина в 3'-положении, и мальвидин — продукт метилирования дельфинидина в 3'- и 5'-положениях. Множество других антоцианидинов имеет более ограниченное распространение. Свободные антоцианидины характеризуются низкой растворимостью, но в растениях они присутствуют в основном в форме гликозидов, образуя так называемые антоцианины. У разных видов цветковых растений в состав антоцианинов входят остатки различных сахаров: глюкозы, рамнозы, арабинозы, галактозы и разнообразных олигосахаридов. Гликозильные остатки присоединяются как к 3-ОН-, так и к 5-ОН-группам.

Цвет антоцианинов в зависимости от pH варьирует от красного до фиолетового и синего. Например, цианин (диглюкозилцианидин) в кислой среде имеет красный цвет, но при диссоциации 4'-ОН-группы становится фиолетовым:
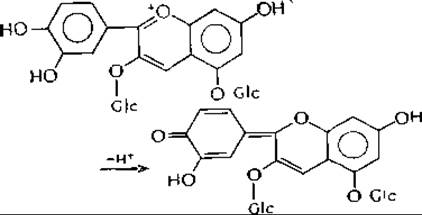
При дальнейшем повышении значений pH диссоциации подвергаются дополнительные гидроксильные группы и цвет пигмента становится синим. Обратите внимание, что как антоцианин, так и его диссоциированные формы могут давать большое количество резонансных структур.
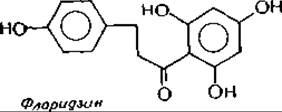
Желтые пигменты растений относятся обычно к флавонолам. Наиболее распространенный из них — рутин, 3а-рамнозил-О-глюкозильное производное кверцитина (см. диаграмму). Однако в мире растений встречается необозримое множество различных флавонолов, флавонов и родственных им соединений. Хорошо известен флоридзин — дигидрохалкон из коры грушевого дерева, яблони и других растений семейства розоцветных. Флоридзин широко используется в физиологических исследованиях, поскольку обладает способностью специфически блокировать резорбцию глюкозы в почечных канальцах, в результате чего наблюдается сильная глюкозурия. Биохимический механизм такого действия флоридзина точно не установлен, но можно думать, что его действие на почечные канальцы связано с ингибированием мутаротазыв.
К флавоновым гликозидам относится гесперидин — вещество, составляющее до 8% сухого веса апельсиновых корок.

Существует мнение (не доказанное), что это соединение, называемое также витамином Р или биофлавоноидом цитрусовых, необходимо для поддержания здоровья.
а Clevenger S., Sсi. Am., 210, 85—92 (June 1964).
б Harborne J. B., Comparative Biochemistry of Flavonoids, Academic Press, New York, 1967.
в White A., Handler P., Smith E. L., Principles of Biochemistry, 5th ed., pp. 415—416, McGraw-Hill, New York, 1973.