Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Ферменты: белковые катализаторы клеток
Регуляция ферментативной активности
Генетический контроль синтеза ферментов
Работа всех регуляторных механизмов клетки определяется в конечном счете генами и их продуктами. Внутри клетки происходит непрерывная транскрипция многих генов, хотя часть генома может не проявляться. К факторам, определяющим скорость синтеза ферментов на рибосомах в цитоплазме, относятся как скорость транскрипции, так и скорость деградации молекул мРНК.
а. Репрессия и индукция
Некоторые ферменты называют конститутивными, подразумевая под этим, что фермент образуется независимо от того, в каких условиях находится клетка. Например, бактерии синтезируют ферменты, необходимые для катаболизма глюкозы, при всех условиях роста. Ферменты другой группы, известные как индуцибельные, часто синтезируются лишь в следовых количествах. Однако если клетки выращивают в присутствии веществ, являющихся субстратами для этих ферментов, то последние продуцируются в гораздо больших количествах. Так, при культивировании Е. coli в присутствии лактозы образуется ряд ферментов, участвующих в катаболизме этого дисахарида. Проведенные исследования показали, что обычно синтез ферментов деградации лактозы подавлен. Гены, кодирующие эти белки, «выключены» благодаря действию специфического белка — репрессора, обладающего аллостерическими свойствами. Репрессор связывается со специфическим участком молекулы ДНК и блокирует транскрипцию генов, ответственных за синтез определенных ферментов (рис. 6-15). Однако индуктор (например, лактоза1), связываясь с аллостерическим центром репрессора, вызывает уменьшение сродства репрессора к ДНК и, следовательно, дерепрессию соответствующих генов.
Синтез многих ферментов в клетке, по-видимому, почти все время подавлен. Появление специфических ферментов в тот или иной момент времени в организме или в определенной дифференцированной ткани происходит в результате дерепрессии, вызываемой накоплением специфических метаболитов или другими, пока неизвестными факторами. В эукариотических клетках контроль за синтезом ферментов может осуществляться как на уровне транскрипции, так и на уровне трансляции.
Репрессия может не только частично сниматься под действием индуктора, но и усиливаться в присутствии конечного продукта метаболической цепи. В некоторых случаях подобная репрессия по типу отрицательной обратной связи также опосредуется аллостерическим изменением молекулы белка — репрессора. У эукариот контроль по типу отрицательной обратной связи может реализоваться, по-видимому, и на уровне транскрипции, и на уровне трансляции, как показано на рис. 6-15.
Уровень активного фермента в клетке определяется не только скоростью его синтеза, но и другими факторами. Некоторые ферменты синтезируются в виде каталитически неактивных проферментов, которые далее переходят в активное состояние обычно в результате частичного протеолиза. Наконец, активные ферменты могут деградировать. Эта деградация происходит либо случайно, либо за счет «запрограммированного» гидролитического расщепления. Таким образом, как и в случае других компонентов клетки, синтез ферментов и их деградация находятся в динамическом равновесии. Результирующий процесс обычно называют обновлением белка [68].
Характерная особенность регуляторных механизмов, действующих на уровнях транскрипции и трансляции, состоит в том, что они являются относительно медленными: время ответной реакции равно часам, а иногда и дням.
б. Изоферменты (изозимы)
Важный аспект регуляции метаболизма связан с тем, что многие ферменты могут находиться в разных формах. Как правило, эти изоферменты не являются изомерами. Скорее это сходные, но химически различающиеся белковые молекулы1). Изоферменты известны уже давно, однако особый интерес к ним возник несколько лет назад, когда было установлено, что лактатдегидрогеназа у человека и большинства животных представлена пятью формами, легко разделяемыми с помощью электрофореза. Каждая форма представляет собой тетрамер, состоящий из субъединиц двух типов. Тетрамер, обладающий наибольшей электрофоретической подвижностью, образован четырьмя идентичными субъединицами типа 1 (называемыми также а- или Н-субъединицами) и часто обозначается как а4. Тетрамер с наименьшей электрофоретической подвижностью, ß4, состоит из четырех субъединиц типа 2 (ß-, или M-субъединицы). Три другие формы (a3ß, а2ß2и аβ3) содержат субъединицы обоих типов в разных соотношениях. За синтез этих двух субъединиц отвечают разные гены, активности которых различны в разных тканях. Так, в сердечной мышце и в печени в основном продуцируются субъединицы типа 1, в то время как в скелетной мышце — преимущественно субъединицы типа 2.
1) Фактически индуктором является изомер лактозы — аллолактоза (гл. 15, разд. Б,1).
Почему клетки продуцируют изоферменты? Прежде всего ферменты с различающимися кинетическими свойствами необходимы для выполнения функций, меняющихся со временем или в зависимости от условий [69]. Так, концентрация субстрата может сильно варьировать от ткани к ткани; такие же различия существуют между митохондриями, ядром и цитоплазмой клетки, а также на разных стадиях развития организма. В случае лактатдегидрогеназы изофермент 1 ингибируется избытком пирувата — продуктом катализируемого этим ферментом окисления лактата:
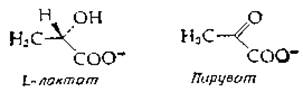
Хотя природа этого ингибирования продуктом неясна2), целесообразность его, по-видимому, можно понять (по крайней мере в какой-то степени) для такого «аэробного» органа, как печень, в которой пируват удаляется окислением; избыточная же активность лактатдегидрогеназы подавляется в ней при накоплении пирувата. В то же время изофермент 2 скелетной мышцы не ингибируется избытком пирувата и отвечает требованиям, предъявляемым к ферменту, который должен восстанавливать пируват до лактата при увеличении мышечной активности3).
Более показательным примером фермента, который может находиться во множестве разных форм, является гексокиназа [схема (6-91)] [70]. Гексокиназа мозга характеризуется низким значением константы Михаэлиса для глюкозы (КМ = 0,05 мМ). Она способна, следовательно, фосфорилировать глюкозу, обеспечивая дальнейший метаболизм этого субстрата, даже когда концентрация глюкозы в мозге падает до очень низкого уровня. В то же время глюкокиназа, изофермент печени, «удаляющий» глюкозу из крови, характеризуется гораздо большим значением КМ (~10 мМ) и его активность становится достаточно высокой лишь при больших концентрациях глюкозы (в крови она обычно составляет ~5,5 мМ).
1) Изоферментами рекомендуется называть только те множественные формы ферментов, появление которых связано с генетически детерминированными различиями в первичной структуре; к ним не относят формы, образующиеся вследствие модификации одной и той же последовательности аминокислотных остатков [см. Рекомендации Комиссии по биохимической терминологии при Международном союзе теоретической и прикладной химии и Международном биохимическом союзе, опубликованные в J. Biol. Chem. (1977), 252, 5939—5941]. —Прим. перев.
2) Химическая природа ингибирования обсуждается в гл. 8, разд. 3.7.а [см. также Сугробова Н. П., Курганов Б. И., Яковлев В. А. (1975), 40, 281—289; Burgner J. W., Ainslie G. R., Jr., Cleland W. W., Ray W. J., Jr. (1978). Biochemistry, 17, 1646—1653; Burgner J. W., Ray W. J., Jr. (1978). Biochemistry, 17, 1654—1661]. — Прим, перев.
3) Подробнее см. обзор Everse J, Kaplan N. О. (1973). Adv. Enzymology, 37, 115—124. — Прим. перев.
Помимо тех причин существования изоферментных форм, о которых мы уже говорили, можно отметить расщепление проферментов, приводящее к образованию множественных форм, частичный гидролиз ферментов, а также обратимую модификацию белковых молекул (последнее обсуждается в разд. Е, 4).
Наличие изоферментов может быть обусловлено также генетическими вариациями в гетерозиготах. Так, если генетически детерминированный вариант определенного белка несет на один положительный или отрицательный заряд больше (или меньше), чем «стандартный» фермент, то при электрофорезе соответствующей белковой фракции у гетерозигот будет обнаружен новый изофермент. Следует отметить, что электрофоретический метод, часто используемый для выявления изоферментов, не позволяет обнаружить генетические варианты, в которых замещения аминокислот не приводят к изменению заряда молекулы.
Изоферменты обозначают самыми разными способами, но в настоящее время принято присваивать им номера в порядке уменьшения их электрофоретической подвижности. Обычно электрофорез проводят при pH 7—9 Большинство ферментов в этом интервале pH заряжено отрицательно. Ферменту, движущемуся с наибольшей скоростью к аноду, приписывается номер 1. Подобный способ уже давно используется при электрофорезе белков крови. Так, глобулины нумеруются в порядке уменьшения их подвижности (а1, а2 и т. д.; см. дополнение 2-А) [71].