Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Ферменты: белковые катализаторы клеток
Классификация ферментов
Согласно рекомендациям официальной Комиссии по ферментам при Международном биохимическом союзе, ферменты разделяются на следующие шесть главных классов [90]:
1. Оксидоредуктазы.
2. Трансферази — ферменты, катализирующие реакции переноса групп.
3. Гидролазы — ферменты, катализирующие перенос групп на молекулу воды.
4. Лиазы — ферменты, катализирующие присоединение групп по двойным связям или отщепление от субстрата той или иной группы с образованием двойной связи.
5. Изомеразы.
6. Лигазы (синтетазы) — ферменты, катализирующие конденсацию с одновременным расщеплением пирофосфатной связи в молекуле АТР или родственные реакции.
Например, согласно системе классификации, разработанной Комиссией по ферментам [90], химотрипсин имеет классификационный номер 3.4.4.5. В настоящей книге использована упрощенная терминология: поскольку систематические названия слишком длинны, в большинстве случаев сохранены привычные тривиальные названия.
Для уточнения всегда следует указывать организм, из которого выделен фермент, и, если это возможно, линию (штамм). Необходимо также отдавать себе отчет в том, что любая генетическая вариация влечет за собой изменение какого-либо белка. Поэтому фермент, с которым вы работаете, может слегка отличаться от того же самого фермента, выделенного в другой лаборатории.
Вопросы и задачи
1. Если фермент катализирует реакцию А→В+С, будет ли он катализировать также реакцию В+С→А?
2. Укажите две причины, по которым ферменты столь важны для живых организмов.
3. Как измеряется начальная мгновенная скорость ферментативной реакции? Какие предосторожности должны быть приняты, чтобы получить именно истинную мгновенную скорость?
4. Что имеют в виду, когда говорят, что биохимические реакции характеризуются стереохимической специфичностью? Исходя из каких соображений следует ожидать, что подобная стереоспецифичность имеет место в живых организмах (построенных из асимметричных соединений)?
5. Как зависит скорость действия ферментов от а) температуры, б) концентрации фермента, в) концентрации субстрата и г) pH?
6. Может ли обратная реакция катализироваться центром фермента, отличным от центра, катализирующего прямую реакцию? Обоснуйте ваш ответ.
7. В чем сходство и различие между ферментативными реакциями и обычными каталитическими реакциями, с которыми имеет дело органическая или неорганическая химия?
8. Сопоставьте ферментативный и неферментативный процессы; как сказывается присутствие фермента на а) изменении стандартной свободной энергии реакции, б) энергии активации реакции, в) начальной скорости реакции, г) температурном коэффициенте константы скорости?
9. Каковы размерности константы скорости для реакций нулевого, первого и второго порядков? Каково значение константы скорости для реакции первого порядка, если время полупревращения составляет 0,5 мин?
10. Радиоактивность препарата гемина, содержащего радиоактивное железо 59Fe, измеряли через определенные интервалы времени при помощи счетчика Гейгера — Мюллера:
|
Время, сут |
Число импульсов в 1 мин |
|
0 |
3981 |
|
2 |
3864 |
|
6 |
3648 |
|
10 |
3437 |
|
14 |
3238 |
|
20 |
2965 |
Вычислите время полураспада 59Fe и константу скорости этого процесса.
11. Аэробное окисление восстановленного ферментативным путем никотинамидадениндинуклеотида (NADH) исследовано при pH 7,38 (30 °С). За реакцией следили спектрофотометрически по уменьшению поглощения (∆А) при 340 нм в течение 30 мин:
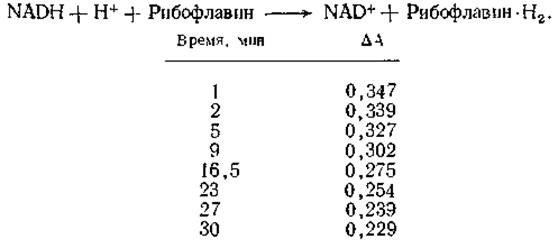
Определите порядок реакции и константу скорости.
12. Используя теорию графов [1, 24], напишите уравнение начальной скорости для следующей системы:
![]()
а) Покажите, что
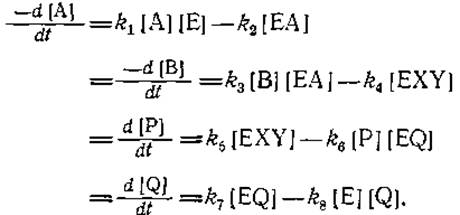
Стационарные концентрации свободного фермента и комплексов фермента с субстратами и продуктами, определяемые с помощью теории графов, равны
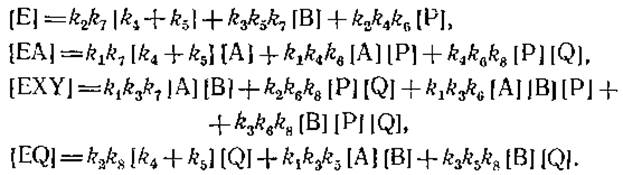
б) Чтобы получить выражение для vf, можно умножить —d[A]/dt на [E]t и разделить на [Е] + [ЕА] + [EXY] + [EQ] = [Е]t. Затем можно подставить выражения для определителей1).
в) Чему равны максимальные скорости прямой (Vf,mах) и обратной (Vr,max) реакций? Примечание: Vf, maxполучаем при условии [Р] = [Q] = 0 и [А] = [В] = ∞. Чему равны KMA и KМB? Примечание: КMA получаем при условии [Р] = [Q] = О, [В] = ∞ и v = Vf,max/2.
г) Покажите, как при известных кинетических параметрах и известной общей концентрации [Е]t можно рассчитать восемь констант скорости.
13. Допустим, что график зависимости скорости ферментативной реакции от концентрации субстрата указывает на то, что имеет место отрицательная кооперативность. Можно ли объяснить ее наличие на основе (Модели Моно, Уаймена и Шанжё для олигомерных ферментов и на основе модели Кошланда, Немети и Филмера? Обоснуйте ваш ответ.
14. На приведенной ниже схеме изображен обобщенный метаболический путь, в котором прописными буквами обозначены основные метаболиты пути, малыми буквами — кофакторы и цифрами — ферменты, катализирующие реакции:
![]()
Перечислите и опишите четыре различных механизма регуляции метаболического пути, указав специфические ферменты, реагенты и кофакторы. Примечание: речь должна идти не о четырех различных реакциях как возможных (пунктах регуляции, а о четырех типах регуляции.
1) Поскольку, в пп. «а» и «б» вопроса 12 имеются неточности, советуем обратиться к какому-либо учебнику по ферментативной кинетике (см., например, Корниш-Боу-Ден Э. Основы ферментативной кинетики. — М.; Мир, 1979; гл. 3, разд. 3,3). — Прим, перед.
15. Объясните характер кривой, являющейся графическим изображением зависимости начальной (не максимальной) скорости ферментативной реакции, измеренной при фиксированной концентрации субстрата, для каждого из следующих случаев:

а) Молекула субстрата нейтральна и не содержит кислотных и основных групп; установлено, что константа Михаалиса не зависит от pH в изученном интервале pH.
б) Молекула субстрата нейтральна и не содержит кислотных и основных групп; установлено, что максимальная скорость не зависит от pH.
в) Субстрат представляет собой а-аминокислоту; максимальная скорость не зависит от pH.