Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Типы реакций, катализируемых ферментами
Реакции присоединения и элиминирования
Присоединение к двойным связям, находящимся по соседству с карбоксильными группами
Часто в биохимических реакциях происходит присоединение к связям С=С, сопряженным не с настоящей карбонильной группой, а с группой —СОО-, являющейся гораздо более слабым акцептором электрона. Если эта группа находится в составе молекулы белка, то она может быть в протонированном состоянии, что делает ее улучшенным акцептором электрона. Тем не менее возникает вопрос, выполняется ли у таких ферментов механизм, показанный в уравнении (7-41). И в самом деле, исходя из различных экспериментальных данных, мы вынуждены предположить наличие совершенно отличного механизма, а именно того, который постулируется для реакции обычной неферментативной гидратации алкенов. Примером такой реакции может служить гидратация этилена горячей водой в присутствии разбавленной серной кислоты как катализатора, лежащая в основе промышленного метода получения этанола:
![]()
К п-электронам двойной связи присоединяется протон, и образующийся в результате карбоний-ион легко отнимает гидроксильный ион от воды. В то же время прямое присоединение ОН--группы с образованием карбоний-иона затруднено, поскольку в молекуле этилена рядом с двойной связью нет карбонильной группы, способной стабилизировать отрицательный заряд.
а. Фумараза [111]
Среди ферментов этой группы лучше всего изучена, пожалуй, фумараза (фумарат-гидратаза, гл. 6, разд. Г,2 и Д,5), представляющая собой тетрамер с мол. весом ~ 200 000 и характеризующаяся числом оборотов около 2∙103 с-1. Продуктом реакции, катализируемой фумаразой, является L-малат (R-малат). Если реакция проводится в 2Н2О, то атом 2Н присоединяется в про-R-положение, т. е. протон присоединяется с re-стороны тригонального атома углерода:

Для получения L-малата гидроксил должен присоединяться по другую сторону двойной связи. Как при ферментативных, так и при неферментативных реакциях такое анти(транс)- присоединение распространено в гораздо большей степени, чем присоединение Н и ОН (или —Y) с одной и той же стороны (син или цис-присоединение, присоединение по одну сторону двойной связи). За исключением двух реакций, в процессе которых образуются необычные структуры, все ферментативные реакции присоединения и отщепления, изученные до сих пор, относятся к анти-присоединению, когда протон подходит с rе-стороны. Это позволило высказать предположение о закреплении в процессе эволюции единого механизма, сходного по основным признакам [112].
Характер pH-зависимости реакций, катализируемых фумаразой, свидетельствует об участии в активном центре как кислотной, так и основной групп (гл. 6, разд. Д,5). Однако эти данные еще не дают основания для выбора между анионным механизмом и механизмом, включающим образование карбоний-иона. Предположение о том, что расщепление связи С—Н не является лимитирующей стадией, сделано на основании следующего наблюдения: малат, содержащий 2Н в пpo-R-положении, дегидратируется с такой же скоростью, как и обычный малат. Если действует анионный механизм [уравнение (7-41)], то это может означать, что 2Н из пpo-R-положения избирательно меченного малата удаляется на быстрой стадии и что уход ОН--группы протекает гораздо медленнее. Если это так, то 2Н должен «отмываться» из L-малата быстрее, чем это могло бы происходить в том случае, когда имеет место превращение в фумарат с последующей регидратацией в малат. В действительности же наблюдается обратная картина: гидроксильная группа отщепляется быстро, а 2Н — более медленно. Эти результаты свидетельствуют о наличии механизма с участием карбоний-иона:
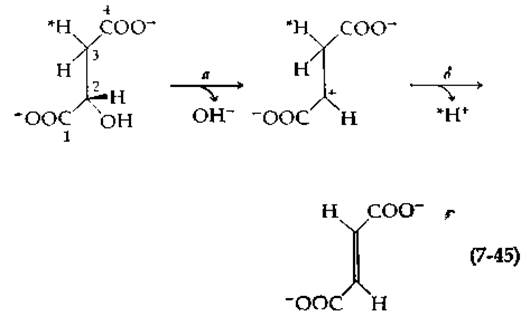
Хотя первичный изотопный эффект при измерениях скорости реакции отсутствует, наблюдались отчетливо выраженные вторичные изотопные эффекты при замене атома водорода у С-2 или атома водорода в рrо- S-положении у С-3 малата на 2Н или 3Н. Так, отношение k(1Н)/k(2Н) составляет 1,09 для атомов водорода, находящихся как в pro-S-положении, так и в положении С-3 [113]. По-видимому, эти наблюдения подтверждают, во-первых, наличие механизма с участием карбоний-иона, а во-вторых, тот факт, что стадия б в уравнении (7-45) является лимитирующей (см. также разд. В, 4,6). Сопоставление величины Vmax для реакции гидратации фумарата, фторфумарата и дифторфумарата (104, 410 и 86 мкмоль ∙ мл-1∙ мин-1∙ мг-1 соответственно) также, вероятно, свидетельствует о реализации механизма с участием карбоний-иона (студенту следует попытаться интерпретировать эти данные, прежде чем обращаться к оригинальной работе) [114].
Недавно выяснилось, что протоны, способные переходить от субстрата к основным группам белка, не обязательно должны быстро обмениваться с растворителем (см. разд. И,2). Действительно, было показано, что протон, отщепляемый фумаразой от малата, удерживается ферментом на протяжении относительно длительного промежутка времени. Скорость обмена протона между малатом и растворителем ниже скорости обмена между связанным фумарат-ионом на поверхности фермента и другой молекулой субстрата, находящейся в среде [115]. Так, оказалось, что суммарная скорость обмена определяется скоростью отщепления продуктов от молекулы фермента и что мы до сих пор не знаем, предшествует ли удаление протона отщеплению ОН- или следует за ним. Однако имеется и третья возможность — протон и гидроксильная группа могут присоединяться одновременно по согласованному механизму [115].
б. Енолаза
Дегидратация 2-фосфоглицерата, приводящая к образованию фосфоенолпирувата, фосфорилированного производного енольной формы пировиноградной кислоты, катализируется ферментом енолазой и является ключевой реакцией метаболизма сахаров:
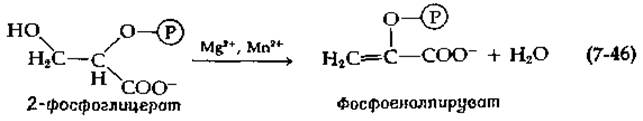
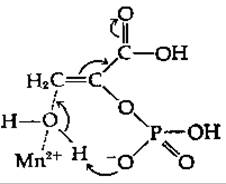
Исходя из данных, полученных при изучении изотопного обмена для этого фермента, было сделано предположение, что протон быстро удаляется, образуя карбанионное промежуточное соединение, распад которого является лимитирующей стадией [116]. Этот фермент функционирует, только находясь в комплексе с ионом металла [117], обычно Mg2+ и Мn2+. Из данных по исследованию релаксации протонов воды, полученных методом ЯМР, следует, что ион Мn2+ образует координационные связи с двумя быстро обменивающимися молекулами воды в свободном ферменте [118]. При связывании субстрата одна из этих молекул воды может быть иммобилизована и участвовать в реакции присоединения. Фосфатная группа субстрата может выступать в роли общего основного катализатора, облегчая отрыв протона от молекулы воды [118]:
в. Аконитаза
Другой фермент этой группы, аконитаза (аконитат-гидратаза), катализирует две реакции: а) дегидратацию цитрата с образованием цис-аконитата и б) регидратацию, протекающую по другому механизму, с образованием изоцитрата:
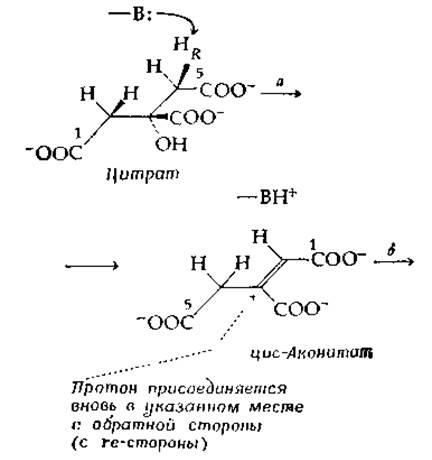

Обе реакции полностью стереоспецифичны. В первой реакции (стадия а) отщепляется pro-R-протон от С-4 (стереохимическая нумерация) цитрата, а на стадии б образуется Tpeo-Ds-изоцитрат. Присоединение протона в обоих случаях происходит с rе-стороны.
Так же, как и в случае фумаразы, фермент удерживает отщепившийся протон в течение достаточно длительного промежутка времени (до 7-10-1 с), что позволяет молекуле цис-аконитата иногда диффундировать от поверхности фермента и (если имеется избыток цис-аконитата) замещаться другой. В результате новая молекула цис-аконитата иногда приобретает протон (межмолекулярный перенос протона). Протон, отщепляемый от цитрата, часто возвращается к молекуле [стадия б в уравнении (7-47)], но, как показано штриховой стрелкой, ведущей к соединению, изображенному в уравнении (7-47) в центре, положение, в котором присоединяется возвращающийся протон, отлично от положения его отщепления. По-видимому, после того, как произошло первоначальное отщепление протона, образующийся цис-аконитат «перескакивает» в такое положение, когда возможна регидратация с участием тех же самых групп, которые принимали участие в дегидратации, но с образованием нового продукта [119]. Не исключено, что именно этот сложный механизм и обусловливает низкое число оборотов (15 с-1).
Молекула аконитазы содержит ион двухвалентного железа (Fe2+), необходимый для проявления ферментативной активности. Хотя существует предположение о том, что ион железа может участвовать в окислительно-восстановительном процессе (протекающем по механизму, отличному от рассмотренного выше), более вероятно, что ион железа облегчает присоединение субстрата к ферменту и образование гидроксильного иона аналогично тому, как это было постулировано для иона Zn2+ в карбоангидразе (разд. 3,2) [120].
г. Присоединение и отщепление других нуклеофилов
Кроме гидроксильных групп в ß-положении к карбоксильной группе могут присоединяться (или отщепляться от нее) и другие группы. Так, бактериальный фермент аспартаза катализирует присоединение аммиака к фумарату с образованием L-аспартата — реакцию, аналогичную реакции, катализируемой фумаразой. При этом наблюдается транс-присоединение, a изотопные эффекты при измерении скорости реакции указывают на механизм с участием карбоний-иона [121]. В то же время ß-метиласпартаза, катализирующая аналогичное присоединение, вызывает быстрый обмен дейтерия из воды с протонами субстрата [122].
Полимеры уроновой кислоты с 1,4-связями, такие, как гиалуроновая кислота, дерматансульфат (рис. 2-16) и пектины (гл. 2, разд. В,3), могут расщепляться группой бактериальных ферментов, использующих механизм элиминирования [123]. Геометрия звеньев галактуроновой кислоты, соединенных ß-связями в молекуле пектина, благоприятна для транс-отщепления 5-Н и О-гликозильной группы в положении 4:

Однако соответствующая гиалуронидаза, действующая на остатки глюкуроновой кислоты, вызывает цис-отщепление. Исходя из этих результатов, можно предположить, что активирующий эффект карбоксильной группы, облегчающей отщепление 5-водородного атома в виде протона, имеет важное значение [124] и что в процессе этой реакции образуется анионное промежуточное соединение. В таком случае отщепление ß-заместителя может происходить либо из экваториального, либо из аксиального положения.
Интересное приложение имеют реакции присоединения к двойной связи, катализируемые некоторыми цис-транс-изомеразами [125]. Эти ферменты содержат сульфгидрильные группы. Одна изомераза превращает малеат в фумарат с числом оборотов 300 с-1; родственные ферменты катализируют изомеризацию малеилацетата и малеилпирувата в соответствующие фумарильные производные:
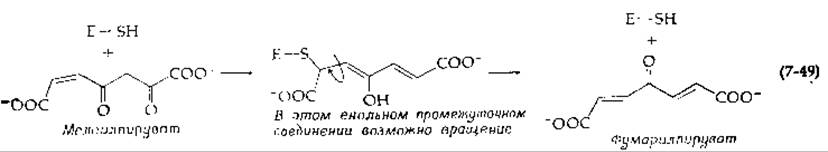
Согласно существующим представлениям, —SH-группы фермента присоединяются к двойной связи. Затем в енольном промежуточном соединении может произойти вращение. Тиоцианат-ион катализирует изомеризацию малеиновой кислоты в отсутствие ферментов по механизму, аналогичному ферментативному.