Биохимия - Химические реакции в живой клетке Том 3 - Д. Мецлер 1980
Свет в биологии
Фотосинтез
Цепи переноса электронов в хлоропластах
Рассмотрим теперь более внимательно процессы, в которые вовлекается далее восстановленный акцептор электронов А- [уравнение (13- 26)], а также процессы, связанные с возвращением электрона на окисленный Хл+. Электродный потенциал пигмента Р700, входящего в хлоропластах в состав фотосистемы I (рис. 13-18), равен +0,43 В, Квант света с длиной волны 700 нм несет достаточное количество энергии (1,77 эВ) для фотовосстановления переносчика, потенциал которого на 1,77 В более отрицателен, т. е. равен —1,3 В. Однако вероятность образования столь мощного восстанавливающего агента очень мала. Во-первых, улавливание энергии света не может идти со 100%-ной эффективностью1). Если фотохимическая реакция проходит через триплетное состояние, то значительная часть поглощенной энергии теряется. Далее, неизвестны переносчики, которые обладали бы таким отрицательным окислительно-восстановительным потенциалом. И, кроме того, мы не знаем электродного потенциала гипотетического переносчика Z. Большинство авторов принимают его равным от ~—0,55 до —0,6 В; это близко к потенциалу ферредоксина, в связи с чем было высказано предположение, что Z представляет собой связанную молекулу ферредоксина. Согласно более поздним данным, в этой роли выступает особый Fe-S-белок [99]. Как бы то ни было, ясно, что Z способен быстро восстанавливать ферредоксин, возможно, с участием неизвестных пока переносящих электрон белков. Восстановленный ферредоксин хлоропластов, будучи одноэлектронным переносчиком (гл. 10, разд. В), может передавать электроны через флавопротеид Fd-NADP—редуктазу на NADP+, в результате чего образуется NADPH.
Для зеленых растений конечное звено цепи переноса электронов четко установлено, чего нельзя сказать о бактериях. В этом случае выявить фотохимический синтез восстановленных промежуточных соединений со значением потенциала, близким к потенциалу ферредоксина, не удалось. Полагают, что акцептором электронов является хинон (вероятнее всего, убихинон) [102]. Поскольку Е0' хинона близко к нулю, для восстановления NАDP+ необходимо использовать «обращенный поток электронов», приводимый в действие с помощью АТР. Обращение потока могло бы иметь место за счет окисления половины фотовосстановленного хинона в цепи переноса электронов окисленным Хл+ реакционных центров, которое сопряжено с синтезом АТР (циклическое фотофосфорилирование).
В хлоропластах кандидатом на роль донора, передающего электроны непосредственно на Р700 и стоящего в цепи переноса электронов, которая идет от фотосистемы II к фотосистеме I (рис. 13-18), можно считать медьсодержащий белок пластоцианин (PC). Важная роль пластоцианина была выявлена при работе с клетками Scenedesmus; в условиях недостатка меди (рис. 1-9) эти клетки не способны к фотовосстановлению СО2 с помощью Н2, но реакция Хилла протекает в них с нормальной скоростью. На другом конце цепи стоит Q, электронный акцептор фотосистемы ІІ. Q — это первая буква английского слова quencher — тушитель; указанный акцептор тушит флуоресценцию хлорофилла Р682, т. е. хлорофилла а, содержащегося в реакционном центре фотосистемы II. Облучение хлоропластов светом с длиной волны 650 нм активирует фотосистему II, но не фотосистему I. В этих условиях Q оказывается в восстановленном состоянии и наблюдается усиление флуоресценции Хл*, что, вероятно, связано с отсутствием акцептора электронов Q. Если же активировать фотосистему I красным светом с большей длиной волны, то Q остается преимущественно в окисленной форме, что и приводит к тушению флуоресценции.
1) Обычно не учитывают, что свет несет с собой не только энергию, но и энтропию. Важным следствием этого является тот факт, что для совершения химической работы может быть использовать лишь 78%, энергии солнечного света с длиной волны 700 нм (Knox R. S.: Biophvs J., 9. 1351. 1969).
Природа соединения Q точно неизвестна, но большинство исследователей считают, что это один из пластохинонов (PQ). Пластохинон А, преобладающий в хлоропластах шпината, имеет структуру, изображенную на рис. 10-8, с девятью изопреноидными звеньями в боковой цепи. В хлоропластах шпината присутствует по меньшей мере шесть других пластохинонов. Особенно широко распространены пластохиноны С, гидроксилированные в различных положениях боковой цепи. В пластохиноне В эти гидроксильные группы ацилированы. Имеется целый ряд других модификаций, включая и различия в числе изопреноидных звеньев в боковых цепях [103, 104]. Таким образом, в цепи переноса электронов может функционировать одновременно несколько разных пластохинонов. По имеющимся оценкам, на каждый реакционный центр приходится около пяти молекул пластохинонов, так что пластохиноны могут служить своего рода электронным буфером между двумя фотосинтезирующими системами. В соответствии с этим считается, что Q представляет собой малый пул пластохинонов, связанный с реакционным центром и отделенный от большего пула реакцией, ингибируемой DCMU.
Обычно считают, что в цепи между фотосистемами II и I имеются два переносчика электронов — цитохром b559 и цитохром f (последний является цитохромом с-типа) [104а]. Хотя высказывались предположения о существовании параллельных путей [105], большинство исследователей полагают, что переносчики расположены в следующей последовательности:
![]()
Последовательность PQ→цитохром b559→цитохром f, по-видимому, весьма близка к последовательности переносчиков в митохондриях [106] убихинон→цитохром bT→цитохром c1, которая содержит участок сопряжения II с синтезом АТР (рис. 10-11). Как указано на рис. 13-18, с синтезом АТР, по-видимому, сопряжен и соответствующий участок цепи переноса электронов в хлоропластах.
Сходство систем переноса электронов в митохондриях и хлоропластах стало еще более очевидным, когда оказалось, что для синтеза АТР необходим сопрягающий фактор хлоропластов CFI, сходный по свойствам с митохондриальным белком FI (гл. 10, разд. Д, 8). Как и сопрягающий фактор митохондрий, фактор CFI состоит из субъединиц пяти разных типов [107, 108]. Подобно митохондриям, хлоропласты (на свету) также «перекачивают» протоны через мембраны. Однако при этом протоны накапливаются внутри тилакоидов, тогда как в митохондриях они выводятся наружу. Сопрягающий фактор CFI находится на наружной поверхности тилaкоидов, обращенной в сторону стромального матрикса, а фактор FI— на внутренней стороне митохондриальной мембраны. Весьма вероятно, что хлоропласта а митохондрии используют один и тот же механизм синтеза АТР.
Существует мнение, что перенос протонов через мембраны тилакоидов сопряжен с циклическим окислением и восстановлением пластохинонов (аналогично тому, как это происходит с убихиноном в митохондриях) и что фотосистема II локализована внутри тилакоидов. В таком случае после расщепления молекулы воды два протона (по одному на электрон) останутся внутри тилакоида, а электроны будут выведены под действием света через двойной липидный слой к акцептору Q, расположенному снаружи. Аналогичным образом можно предположить, что хлорофилл в фотосистеме II локализован с внутренней стороны двойного слоя, а акцептор Z — снаружи (рис. 13-18). Поскольку в ходе происходящего с наружной стороны восстановления NAD+ в NADH высвобождается протон, в сумме происходит перекачивание полутора протонов на каждый электрон, проходящий через Z-систему [107, 109]. Согласно химио-осмотической гипотезе (гл. 10, разд. Д,9, в), источником свободной энергии, необходимой для синтеза АТР, является именно Перенос протонов, приводящий к появлению градиента pH и мембранного потенциала.
Пути, в ходе которых осуществляется циклическое фотофосфорилирование в хлоропластах, пока не установлены. Полагают, что в этом процессе участвует цитохром b563 (цитохром b6), но неясно, направляются ли электроны далее к пластохинонам или поступают прямо на цитохром f.
Большой интерес представляет фотофосфорилирование неорганического фосфата в пирофосфат (РРі), осуществляемое хроматофорами из R. rubrum. Имеются данные, что образовавшийся таким образом РРi далее вовлекается в целый ряд различных энергозависимых реакций идущих в хроматофорах [110]. Одним из примеров такого рода служит образование NADH в результате обращения потока электронов. Сразу Же возникает вопрос: как согласовать эти данные с положением о том, что PPi всегда немедленно гидролизуется (гл. 11, разд. Б, 2)? Не исключено, что не только в бактериях, но и в других организмах РРі иногда используется как дополнительный источник энергии.
Что касается донора электронов в фотосистеме II, то имеются веские данные о непосредственном участии в этом процессе двух-четырех йонов Мn2+, присутствующих в каждом из реакционных центров [111]. Поэтому цепь часто изображают идущей от Н2O через Мn2+ на Р682. Была предложена специальная схема [112], отражающая прямое взаимодействие между окисленным хлорофиллом и гидроксил-ионом воды, связанным с металлом координационной связью:

Как и чрезвычайно сложный механизм восстановления O2 цитохром-оксидазой - компонентом щепи переноса, электронов в митохондриях (гл. 10) - дегидрирование в хлоропластах двух молекул воды с образованием одной молекулы O2, протекающее с участием четырех электронов, трудно изобразить в виде простой схемы. В ходе экспериментов по исследованию процесса выделения кислорода под действием периодически повторяющихся световых импульсов было установлено, что в системе II в его основе лежит четырехквантовый процесс [112а]. Окисляющие эквиваленты на этом конце цепи должны каким-то образом сохраняться, пока их количества не станет достаточно для выделения молекулы кислорода. Все эти события происходят в центре металлофермента (см. дополнение 13-А), вероятно, с участием двух ионов Мn2+. Каждый ион Мn2+ после связывания с радикалом по схеме (13-29) может быть окислен до Мn3+, обеспечивая совершение второго акта поглощения света, в результате чего связывается еще один ОН-радикал. В итоге образование молекулы O2 можно схематически представить следующим образом:
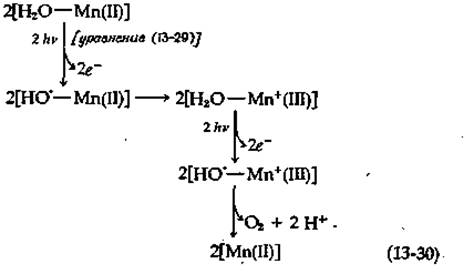
Еще одним моментом, связанным с переносом электронов на этом конце цепи, является возможное наличие особого участка, где запасается энергия, необходимая для синтеза АТР [113]. В этом случае процесс должен включать большее число стадий, чем указано на схеме (13-30), что делает его еще ближе к цитохромоксидазной системе, работающей в обратном направлении. Хотя в целом природа процессов, протекающих на завершающей стадии образования O2, еще далеко не ясна, исследования в этом направлении в какой-то степени облегчаются в связи с открытием специфических ингибиторов. Так, гидроксиламин, по-видимому, блокирует окисление Н2О, не влияя на перенос электронов от искусственных доноров через фотосистемы II и I.
Поскольку при образовании углеродсодержащих продуктов фотосинтеза главным процессом, по всей видимости, служит включение СО2 через цикл Кальвина (гл. 11, разд. Г,2), источником восстанавливающих эквивалентов должен быть процесс расщепления, шести молекул воды с одновременным выделением О2. В противном, случае уравнение (13-25) не будет выполнено. Тем не менее имеются данные, что непосредственным источником кислорода при образовании О2 являются ионы бикарбоната [114]. Более поздние эксперименты показывают, что 18О из бикарбоната не включается в О2, но бикарбонат все же стимулирует выделение кислорода [115], действуя, по всей вероятности, как аллостерический эффектор.
Дополнение 13-А
Марганец
Обычно содержание марганца в тканях составляет в пересчете на сухой вес менее одной части на миллион, что отвечает средней концентрации его в свежих тканях 0,01 мМ (для сравнения укажем, что концентрация присутствующего в больших количествах в животных тканях Mg2+ составляет 10 мМ). Содержание марганца в костях несколько выше (3,5 млн-1). Тем не менее этот элемент является необходимым компонентом пищиа,б, и его недостаток приводит к заболеваниям с четко выраженными симптомами, в частности к дегенерации ткани яичников и семенников, к укорочению и искривлению конечностей и к другим деформациям скелета. В костях и хрящах становится заметно меньше органического матрикса. Понижается содержание в хрящах галактозамина, а также гиалуроновой кислоты и хондроитинсульфатов. Очень важен этот элемент и для роста растений.
Марганец расположен в середине первой переходной группы элементов. Устойчивый ион Мn2+ имеет пять 3d-электронов с максимальным суммарным спином. Большую роль в функционировании некоторых ферментов играет, по всей вероятности, менее устойчивый ион Мn3+, который, возможно, участвует также в процессе высвобождения кислорода при фотосинтезе [схема (13-30)].
Специфической потребностью в Мn2+ обладает поразительное число ферментов. К ним относятся галактозил- и N-ацетилгалактозаминил—трансферазыв, участвующие в синтезе мукополисахаридов (гл. 12, разд. В, 1), а также лактозосинтетаза [уравнение (12-11а)]. Пируваткарбоксилаза [уравнение (8-2)] содержит четыре прочно связанных иона Мn2+, по одному на каждую из молекул биотина. Ион марганца необходим для каталитического действия фермента на стадии транскарбоксилирования; помимо этого, Мn2+ или Mg2+ нужны на начальной стадии карбоксилирования биотина.
Марганец является компонентом вишнево-красной супер-оксиддисмутазы из Е. coli [уравнение (8-61); см. также дополнение 10-3]. Этот фермент с мол. весом 40 000 содержит два атома Мn(III). Аналогичные ферменты были выделены из митохондрий куриной печени и из дрожжей. Дрожжевой фермент представляет собой тетрамер; каждая субъединица с мол. весом 24 000 содержит один атом связанного марганца1). Белок, известный под названием авиманганина, по-видимому, является неактивной формой куриного фермента. Интересно, что цитоплазматические супероксиддисмутазы из тех же источников являются Cu-Zn-ферментами (дополнение 10-3)д. Ионы марганца в супероксиддисмутазах в ходе катализа реакции, описываемой уравнением (8-61), как полагают, совершают переходы между состояниями окисления II и III. То же, вероятно, относится к содержащему марганец белку (или нескольким таким белкам) в хлоропластах [уравнение (13-30)]. Еще одним белком, содержащим Мn2+, является конканавалин А (рис. 5-7).
Многие из белков, нуждающихся в Mg2+, могут вместо него использовать Мn2+, и этим обстоятельством химики нередко пользовались при изучении активных центров ферментов6. Сильный парамагнетизм Мn2+ позволяет применять метод ЭПР (дополнение 5-Б), а также исследовать парамагнитную релаксацию сигналов ЯМР (гл. 7, разд. Д, 7). Марганец может замещать и Zn2+ в цинкзависимых ферментах, иногда вызывая интересные изменения их каталитических свойствж.
Возможно, функция марганца состоит в регуляции активности ферментов. Например, известно, что глутаминсинтетаза (гл. 14, разд. Б, 2) в одном из состояний активна только в присутствии Mg2+, но при аденилировании прочно связывает Мn2+. Многие нуклеазы и ДНК-полимеразы при замещении Mg2+ на Мn2+ изменяют свою специфичность. Каково значение этих различий in vivo, сказать пока трудно, но о них следует помнить.
Мn2+ накапливается внутри бактериальных спор (гл. 16, разд. В, 1). Для Bacillus sublilis присутствие Мn2+ является абсолютно необходимым условием инициации споруляции. На стадии логарифмического роста бактерии при выращивании их в среде, содержащей Мn2+ в концентрации 1 мкМ, могут накапливать его внутри клеток до концентрации 0,2 мМ; в ходе споруляции концентрация Мn2+ становится еще вышеи.
а O’Dell В. L., Campbell В. J., Cornpr. Biochem., 21, 191—203 (1971).
б Leach R. М., Jr., in: Trace Element Metabolism in Animals-2 (W. G. Hoekstra et al., eds.), pp. 51—59, Univ. Park Press, Baltimore, Maryland, 1974.
в Baker A. P.. Griggs L. J., Munro J. R., Finkeistein J. A., JBC, 248, 880— 883 (1973).
г Villafranca J. J., Yost F. J., Fridovich I., JBC, 249, 3532—3536 (1974).
д Ravindranath S. D., Fridovich J., JBC, 250, 6107—6112 (1975).
e Mildvan A. S., Annu. Rev. Biochem., 43, 357—399 (1974).
ж Нaffner P. H., Goodsaid-Zalduondo F., Coleman J. E., JBC, 249, 6693— 6695 (1974).
з Villafranca J. J., Wedler F. C., Biochemistry, 13, 3286—3291 (1974).
и Deuel T. F., Prusiner S., JBS, 249, 257—264 (1974).