Биохимия - Химические реакции в живой клетке Том 3 - Д. Мецлер 1980
Свет в биологии
Зрение
Химическая природа хромофоров зрительных пигментов
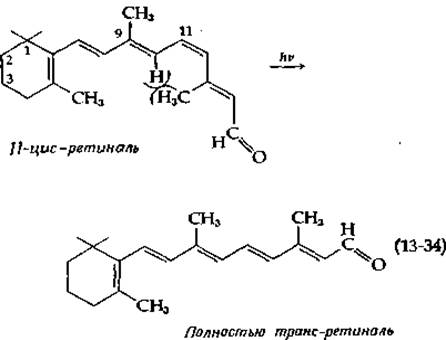
Хромофором родопсина является 11-цис-ретиналь, который под действием света изомеризуется [схема (13-34)] в полностью транс-ретиналь. Последний отщепляется от белковой части молекулы — апобелка опсина, который далее может самопроизвольно рекомбинировать с 11-цис-ретиналем с образованием родопсина.
Известны и другие, родственные родопсину зрительные пигменты. Опсины колбочек в комплексе с 11-цис-ретиналем называют порфиропсинами; обычно они поглощают свет с несколько большими длинами волн, чем родопсин1). У отдельных пресноводных видов хромофрром зрительных пигментов (иодопсинов) является 3-дегидроретиналь. Положение максимума поглощения зрительных пигментов зависит как от природы связанного альдегида, так и от природы белка, причем последний оказывает больший эффект (табл. 13-3). Таким образом, ретинальсодержащие пигменты поглощают свет в широком диапазоне длин волн, охватывающем интервал 467—528 нм (18 900—21 400 см-1).
Таблица 13-3 Положение основных максимумов поглощения ретиналей и зрительных пигментов
|
Свободный альдегид |
Зрительный пигмент |
||
|
Ретиналь (полностью транс) |
387 нм 25 800 см-1 |
||
|
Ретиналь (11-цис) |
376 нм 26 600 см-1 |
Родопсин |
500 нм 20 000 см-1 |
|
Порфиропсин (колбочки) |
522 нм 19 200 см-1 |
||
|
3-дегидроретиналь (11-цис) |
393 нм 25 400 см-1 |
Иодопсин |
562 им 17 800 см-1 |
При обработке нативного родопсина боргидридом натрия реакция восстановления бывает выражена довольно слабо, но после выцветания белка восстановление протекает быстро и ретиналь ковалентно связывается с белком с образованием вторичного амина. Это означает, что в родопсине ретиналь связан с белковой частью молекулы через шиффово основание. Попытки идентифицировать аминогруппу, к которой присоединено это основание, дали противоречивые результаты.
1)Однако у приматов цветовое зрение, по всей видимости, определяется тремя пигментами с λmах = 447 нм (сине-фиолетовая область), 540 нм (зеленая) и 577 нм (желтая); см. MacNichol Е. F., Jr, Sci. Am., 211, 48—56 (Dec. 1964). Заметим, что один из пигментов поглощает свет с меньшими длинами воли, чем родопсии.
Одни эксперименты указывали на участие ε-аминогруппы опсина, другие — аминогруппы фосфатидилэтаноламина. Недавно, медленно восстанавливая необеспеченный родопсин с помощью цианборгидрида, удалось получить единственный продукт, анализ которого позволил заключить, что шиффово основание в нативном пигменте образовано по аминогруппе лизина [133]. Согласно результатам исследований модельных систем, сильный батохромный сдвиг спектра поглощения зрительных пигментов относительно спектра свободного ретиналя обусловлен наличием в последних сильно протонированного шиффова основания и сильным взаимодействием между полиеновой цепью ретиналя и белком.