Биохимия - Химические реакции в живой клетке Том 3 - Д. Мецлер 1980
Метаболизм азотсодержащих соединений
Фиксация N2 и другие превращения неорганических соединений азота
Нитрогеназная ферментная система
Бесклеточные препараты нитрогеназы были выделены из целого ряда организмов. Всем этим ферментам свойственна быстрая инактивация в присутствии кислорода, что на первых порах сильно сдерживало развитие исследований. По-видимому, фиксация азота происходит в анаэробных участках клеток. Существует даже предположение, что леггемоглобин защищает азотфиксирующие ферменты корневых клубеньков от воздействия кислорода. Возможно, что леггемоглобин осуществляет также доставку O2 путем облегченной диффузии в аэробные митохондрии бактероидов при устойчиво низком давлении кислорода [8].
Нитрогеназная система катализирует шестиэлектронное восстановление N2 в аммиак:
![]()
Она способна восстанавливать и многие другие соединения. Например, восстановление ацетилена в этилен [уравнение (14-2)] является двухэлектронным процессом:

В результате другого двухэлектронного восстановления происходит превращение азид-аниона в N2 и NH+4 [уравнение (14-3)]. Цианид-ионы дают начало метану и аммиаку [уравнение (14-4)]. Нитрогеназная система может также восстанавливать алкилнитрилы и N2O. Кроме того, нитрогеназы неизменно катализируют восстановление протонов в Н2 [уравнение (14-5)].
В экспериментах, выполненных в ранний период исследований, было обнаружено, что для фиксации N2 в бесклеточных экстрактах требуется пируват натрия. Наблюдалось также накопление в больших количествах СO2 и Н2. Оказалось, что пируват расщепляется под действием пируват-формиат-лиазы (рис. 8-19), поставляя клеткам два важных продукта: АТР и восстановленный ферредоксин. Пируват можно было заменить смесью ATP, Mg2+ и Fdвоccт. Кроме того, восстановленный ферредоксин можно было заменить небиологическим восстановителем дитионитом (S2О2-4). Поскольку ADP оказывает на нитрогеназную систему ингибирующее действие, лучшим способам образования АТР оказалось использование ATP-генерирующей системы в виде смеси креатинфосфата (дополнение 10-Е), креатинкиназы и небольшого количества ADP.
В каждом случае исследовавшуюся нитрогеназную систему можно было легко разделить на два компонента. Один из них, азоферредоксин (azoFd, известный также как компонент II), представляет собой чрезвычайно чувствительный к кислороду Fe-S-белок. Азоферредоксии состоит из двух идентичных пептидных цепей с одинаковым (30 000) мол. весом. Каждый димер содержит четыре атома Железа. 4S2- и 12 титруемых тиоловых групп. Другим компонентом служит молибдоферредоксин (MoFd, называемый также компонентом I), который содержит железо, молибден и лабильный сульфид. В этом белке имеются пептидные цепи двух типов, с мол. весом ∼51 000 н 60 000, составляющие смешанный (a2ß2) тетрамер. Каждый смешанный тетрамер содержит два атома молибдена, ~24 атома железа, ~24 сульфид-иона и ~30 титруемых тиоловых групп, вероятно составляющих по три Fe4S4-кластepa на каждый атом молибдена (гл. 10, разд. В). В результате ассоциации этих белков образуется нитрогеназный комплекс, содержащий две димерные молекулы azoFd и одну молекулу MoFd (рис. 14-1).
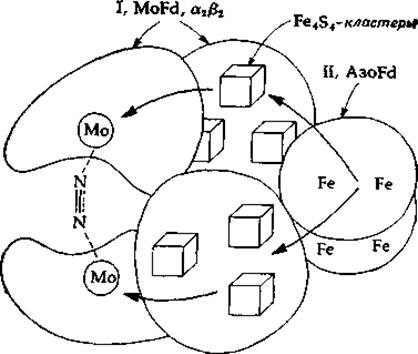
РИС. 14-1. Гипотетическая структура молекулы ннтрогеназы.
При восстановлении azoFd наблюдается сигнал ЭПР с g = 1,94, типичный для Fe-S-белков (гл. 10, разд. В). На этот сигнал сильное влияние оказывает взаимодействие Mg2+ и АТР; вместе с тем на сложную совокупность сигналов ЭПР, наблюдаемых при восстановлении MoFd, АТР никакого действия не оказывает. Из этих и других наблюдений сложилось представление о том, что azoFd служит переносчиком электронов, ответственным за восстановление молибдена, содержащегося в MoFd. Образовавшийся таким путем Mo(IV) далее восстанавливает N2 путем двухэлектронного процесса, сопровождающегося образованием Mo (VI) [уравнение (14-6)]:
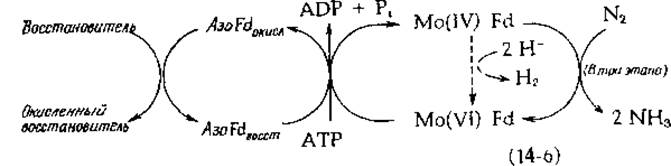
Согласно этой схеме, для полного восстановления N2 до двух молекул аммиака требуются три последовательные двухэлектронные стадии. Альтернативным процессом служит восстановление двух протонов в Н2, как это указано штриховыми стрелками в уравнении (14-6). АТР, по-видимому, приводит в действие поток электронов аналогично идущему под действием АТР «обратному потоку электронов» в дыхательной цепи (гл. 10, разд. Д, 7). Это также схематически показано в уравнении (14-6). Было показано [9], что АТР прочно связывается с azoFd и понижает Е0' (pH 7,5) с —0,29 до —0,40 В. Как ни удивительно, но большинство исследователей обнаруживали, что на перенос двух электронов расходуется 4—5 молекул АТР. Восстановление N2 восстановленным ферредоксином [уравнение (14-7)] с термодинамической точки зрения может идти самопроизвольно:
![]()
Однако N2 химически необычайно инертен. Таким образом, для преодоления высокого активационного барьера распад АТР, возможно, должен быть сопряжен с работой иитрогеназной системы более чем одним путем [10]. Не исключено и то, что in vivo потребность в АТР ниже, чем в изолированных системах.
У некоторых бактерий, например у строгого анаэроба Azotobacter, донором электронов для восстановления N2 служит NADPH. AzoFd, согласно имеющимся данным, предпочтительно акцептирует электроны, поступающие из цепи переносчиков, включающей по крайней мере обычный бактериальный ферредоксин (Fd) и специальный одноэлектронный акцептор азотофлавин [11]. Этот флавопротеид, несколько более крупный, чем флаводоксины (гл. 8, разд. И, 5), по-видимому, играет особую роль в фиксации N2. Предполагаемая система переноса электронов схематически представлена в уравнении
![]()
Дополнение 14-А
Молибден
Уже давно признано, что молибден относится к элементам, необходимым растениям для роста, однако никаких убедительных данных об обязательном его присутствии в пище животных пока не получено. Тем не менее он обнаружен по крайней мере в трех ферментах животных и, кроме того, еще в четырех ферментах бактерий и растенийа,б. Альдегидоксидаза, ксантиноксидаза печени (т. 2, стр. 265) и родственные ксантиндегидрогеназы некоторых бактерий содержат молибден, существенный для проявления каталитической активности. Сульфитоксидаза печени (гл. 14, разд. Ж), нитратредуктаза бактерий и растений (гл. 10, разд. Е.2), бактериальная формиатдегидрогеназа (гл. 9, разд. В, 3) и нитрогеназа (данный раздел книги) — вот список известных ферментов, активность которых зависит от присутствия молибдена.
Молибден — металл второй переходной группы, один из немногих тяжелых элементов, заведомо существенных для жизни. В наиболее устойчивом окисленном состоянии, Mo(VI), молибден содержит заполненную 4S-оболочку и имеет 4d-opбитали, доступные для образования координационных связей с анионными лигандами. Предпочтительными являются координационные числа 4 или 6, но к молибдену могут присоединяться по меньшей мере восемь лигандов. Большая часть комплексов образуется с оксикатионом МоО2+2. Когда с этим ионом координационно связаны две молекулы воды, их протоны приобретают настолько кислые свойства, что полностью диссоциируют, оставляя комплекс в виде молибдат-иона МоО2-4. Другие уровни окислеиности находятся в интервале от Мо (ІІІ) до Mo(V). В этих менее окисленных состояниях тенденция протонов в координационно-связанных лигандах к диссоциации выражена слабее; например, Мо(Н2O)3+6 не от дает протоны даже я сильноосновной среде. Молибдену свойственно образование димерных и полимерных ионов, соединенных кислородными мостиками.
Все содержащие молибден ферменты имеют мол. вес 100 000 или выше и часто содержат по два атома молибдена. Однако никаких данных об образовании димера атомами молибдена нет; димер образуют скорее субъединицы белка, с которыми связан металл. Нитратредуктаза Е. coli, насколько известно, содержит крупную субъединицу с мол. весом 150 000, меньший пептид с мол. весом 55 000, один атом Мо, 12 атомов негемового железа и 12 сульфидовв, не устойчивых к кислотам. Она образует также димеры и тетрамеры. Имеются данные, согласно которым молибден во всех этих ферментах присутствует в составе низкомолекулярного кофактораг.
Точный механизм участия молибдена в катализе неизвестен. Состояния Мо(ІІІ) и Mo(V) парамагнитны, но легко регистрируемые ЭПР-сигналы отвечают лишь состоянию Mo(V). Этот сигнал легко распознать по его характерной сверхтонкой структуре, содержащей шесть линий. Такой сигнал был зарегистрирован в случае ксантиноксидазы, нитратредуктазы и сульфитоксидазы при их взаимодействии с субстратами. Однако нитрогеназа дает только сигналы ЭПР, характерные для железа. Более того, нет никаких данных, из которых следовало бы, что N2 в нитрогеназе реагирует непосредственно с атомами молибдена. Тем не менее заманчиво предположить, что присутствие молибдена в нитрогеназе связано со способностью Mo(VI) акцентировать три электрона с образованием Мо(ІІІ). Два атома Мо(ІІІ), отдавая далее по три электрона, могли бы доставить те шесть электронов, которые нужны для осуществления реакции (14-10).
С молибденом в организме может конкурировать вольфрам. Так, у крыс, получающих с пищей вольфрам в количестве 100 ч. на млн., образуется вольфрамсодержащая сульфитоксидаза, которая уже неспособна нормально функционироватьд. Однако при этом в еще больших количествах накапливается не содержащий металла апобелок. У этих крыс образуется также и неактивная, не содержащая металла ксантиноксидазае. Очевидно, вольфрам каким-то образом препятствует включению молибдена в молекулы ферментов. Большая часть молибдена в азотфиксирующих бактериях Azotobacter находится в специальном белке, предназначенном для накопления молибденаж.
а Bowden F. L., in: Techniques and Topics in Bioinorganic Chemistry (C. A. McAuliffe, ed.), pp. 207—267, Macmillan, New York, 1975.
6 A Symposium on Molybdenum, J. Less-Common Met., 36, 405—533 1974.
B Lund K., DeMoss J. A., JBC, 251, 2207—2216 (1976).
r Nason A., Lee K., Y., Pan S.-S., Erickson R. H., J. Less-Common Met., 36, 449—459 (1974).
д Johnson J. J., Cohen H. J., Rajagopalan К. V., JBC, 249, 5046—5055 (1974).
e Johnson J. J., Wand W. R., Cohen H. J., Rajagopalan, JBC, 249, 5056— 5061 (1974).
ж Brill W. J., Am. Chem. Soc., Cent. Meet., New York, 1976 Abstracts INOR 138 (1976).