Биохимия - Химические реакции в живой клетке Том 3 - Д. Мецлер 1980
Метаболизм азотсодержащих соединений
Соединения, образующиеся из аспартата
Катаболизм лизина
Катаболизм лизина необычен в том отношении, что между а-аминогруппой и общим «азотным фондом» не устанавливается равновесие. Однако катаболизм начинается с дезаминирования и дальше идет через ß-окисление. Имеются данные по меньшей мере о шести вариантах процесса ß-окисления для расщепления лизина. Возникшие в процессе эволюции различия касаются путей отщепления двух аминогрупп от углеродного скелета. В случае пути, кажущегося наиболее простым (путь А на рис. 14-8) — этот путь используется Flavobacterium fuscum [51], — ε-аминогруппа отщепляется в результате прямого (но атипичного) переаминирования. Образующийся полуальдегид а-аминоадипината окисляется в а-аминоадипинат. Последний распадается путем последовательного ряда реакций, характерных для катаболизма аминокислот: за переаминированием следует окислительное декарбоксилирование образующейся а-кетокислоты и ß-окисление ацил-СоА-производного. При распаде лизина в последовательность реакций ß-окисления дополнительно включается стадия декарбоксилирования концевой карбоксильной группы.
Переаминирование, которым начинается путь А, по-видимому, сопряжено с определенными химическими трудностями, а потому большинство организмов использует более сложные последовательности реакций, ведущих к образованию а-кетоадипината. Когда процесс идет по пути Б (который реализуется в митохондриях печени и считается основным у млекопитающих) [52], ε-аминогруппа в результате реакции конденсации и восстановления присоединяется к а-кетоглутарату, образуя сахаропин. В последнем окисляется связь по другую сторону от мостикового атома азота, давая в качестве продуктов глутаминовую кислоту и полуальдегид а-аминоадипината. Суммарное уравнение процесса совпадает с уравнением прямого переаминирования и, по сути дела, представляет собой идущий в обратном направлении аминоадипинатный путь биосинтеза.
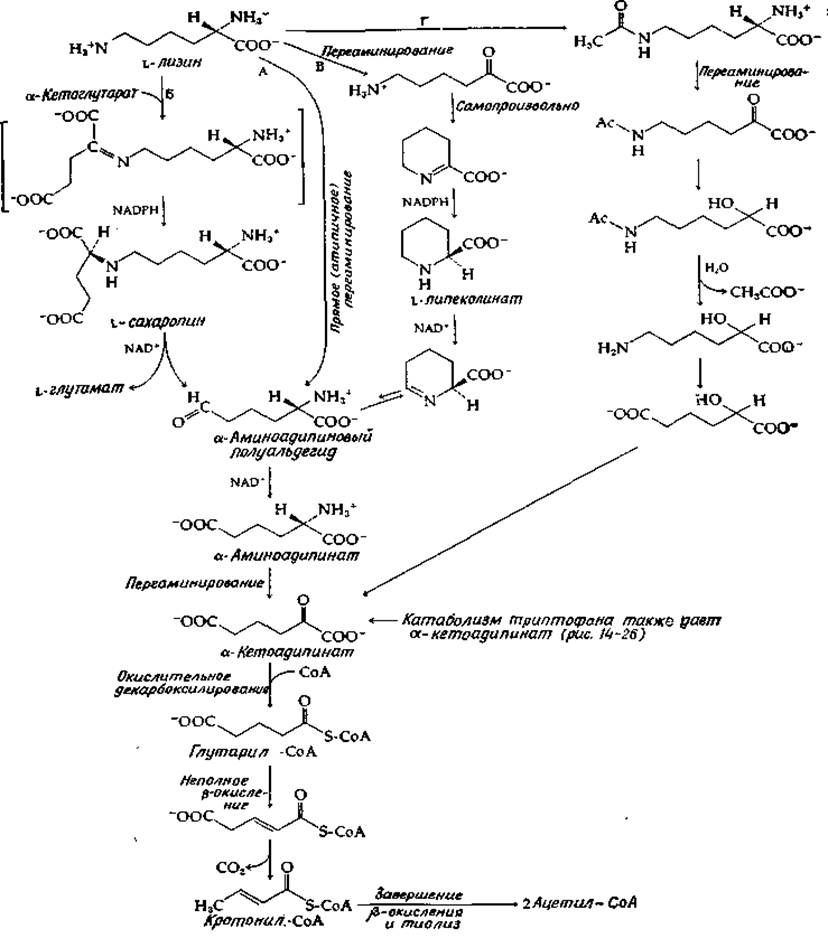
РИС. 14-8. Катаболизм лизина.
Первоначально считали, что путь В занимает важное место в метаболизме млекопитающих, но, как оказалось, он может быть использован только для расщепления D-лизина. Этот путь, установленный для Pseudomonas putlda [53], тоже представляет собой переаминирование, проходящее через последовательные этапы восстановления и окисления. На этот раз процесс носит внутримолекулярный характер: выступающая в роли окислителя карбонильная группа образуется путем переаминирования а-аминогруппы лизина. На пути Г, который, по-видимому, используется в дрожжах [54], ацетилирование а-аминогруппы, предшествующее переаминированию, позволяет избежать образования промежуточных циклических соединений. Далее а-кетогруппа эффективно блокируется путем восстановления в спирт, затем отщепляется ацетильная группа, блокировавшая ε-аминогруппы, и этот конец молекулы прямым путем окисляется с образованием карбоксильной группы.
На этой стадии гидроксил, введенный в положение 2, по-видимому, окисляется обратно в карбонил, в результате чего снова образуется а-кетоадипинат. (Однако еще не совсем ясно, в какой именно точке путь Г сливается с другими путями.)
Некоторые бактерии, и в частности Pseudomonas putida [53], разлагают молекулу L-лизина с помощью оксигеназы [уравнение (10-49)], превращая ее в δ-аминовалерамид:
![]()
Продукт гидролизуется и окисляется в глутарил-СоА, включаясь таким образом в метаболические пути, показанные на рис. 14-8. Примечательный и совершенно иной подход к разрушению лизина обнаружен у бактерии рода Clostridium [55], которые получают энергию путем брожения, описываемого уравнением (14-27).
![]()
Реакция сопряжена с образованием одной молекулы АТР из ADP и Pi. Процесс развивается двумя путями. В первом из них лизин под действием зависимой от пиридоксальфосфата L-лизин-2,3-аминомутазы [56] [уравнение (14-28), стадия а] превращается в ß-лизин (3,6-диаминогексаноат). Последний изомеризуется далее [уравнение (14-28), стадия б] под действием ß-лизинмутазы, кофакторами которой являются одновременно витамин B12 и PLP [57]. Последующее окислительное-дезаминирование, приводящее к образованию 3-кетосоединения [уравнение (14-28), стадия в], делает возможным разрыв цепи. Читатель, сможет сам легко наметить возможные дальнейшие реакции разрыва цепи, синтеза АТР и элиминирования аммиака [58] с учетом сбалансированности окислительно-восстановительных звеньев. Существует и другой путь, начинающийся с действия рацемазы [уравнение (14-28), стадия г] и изомеризации образующегося D-лизина другим В12- и PLP- зависимым ферментом [уравнение (14-28), стадия д]. Далее, очевидно, происходит окислительное дезаминирование. Что же касается механизма разрыва цепи, то в этом вопросе ясности нет. Известно лишь, что он происходит между атомами С-4 и С-5, как указано штрихами в уравнении 14-28.
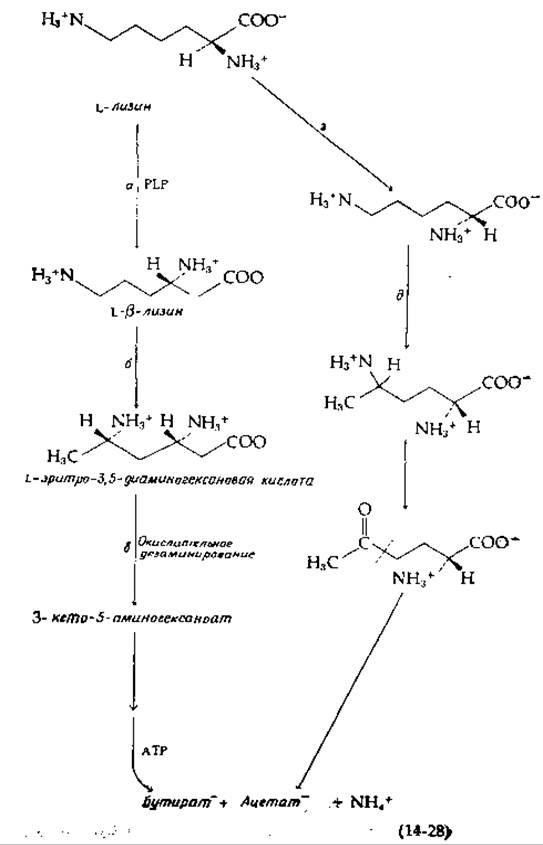
Чем можно объяснить наличие столь многих путей распада лизина? Ответ, вероятно, заключается в той легкости, с какой происходит самопроизвольное замыкание промежуточных соединений в циклы, как это наблюдается на пипеколинатном пути (рис. 14-8, путь В). Такие соединения могут оказаться слишком устойчивыми для эффективного осуществления метаболизма, что и привело к появлению обходных путей. В случае процесса брожения накладываются дополнительные ограничения, связанные с необходимостью обеспечения сбалансированности окислительно-восстановительных процессов, понижающих свободную энергию.