Биохимия - Химические реакции в живой клетке Том 3 - Д. Мецлер 1980
Метаболизм азотсодержащих соединений
Цистеин и метаболизм серы
Цистеин является не только существенным компонентом белков, но, кроме того, относится к тем соединениям, через которые проходит основной путь включения неорганической серы в состав органических соединений. В силу этого он участвует во множестве метаболических процессов. Автотрофные организмы осуществляют последовательное восстановление сульфата в сульфит и далее в сульфид (H2S). Именно эти восстановленные соединения серы и включаются в состав органических соединений. Животные же используют готовые органические соединения серы, образовавшиеся в организме автотрофов; в организме животных эти соединения вступают на путь активного окислительного метаболизма, в ходе которого они разлагаются, а сера снова окисляется в сульфат.
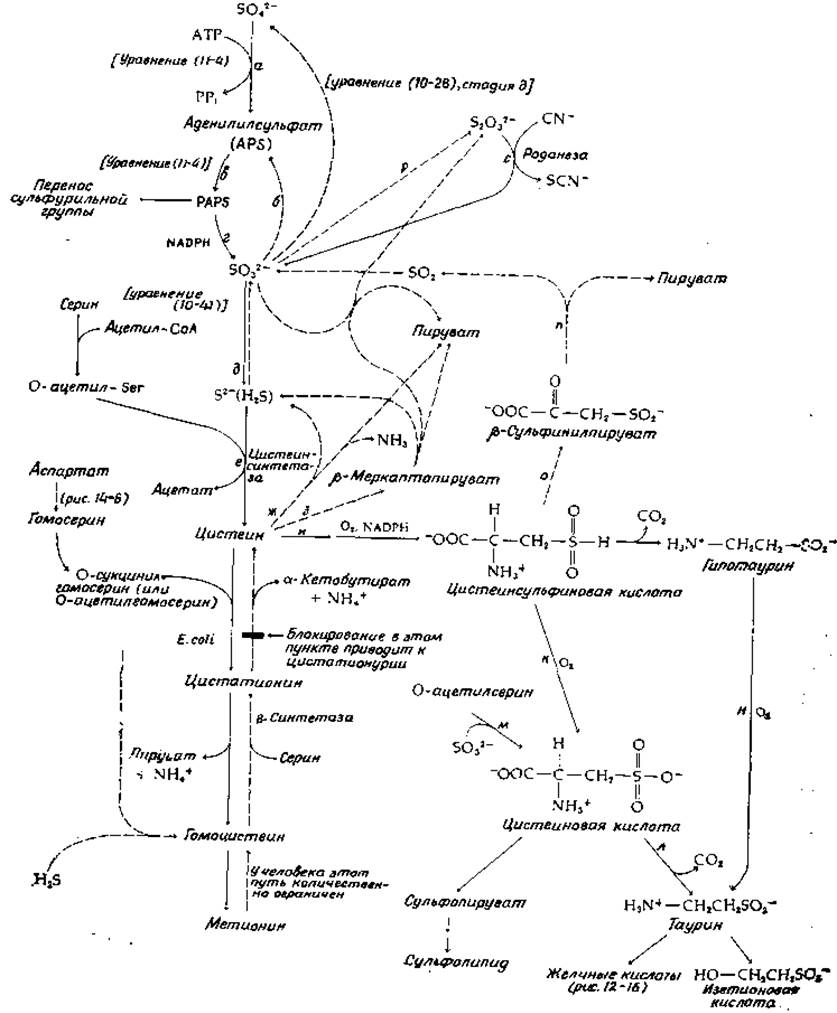
РИС. 14-15. Пути биосинтеза и катаболизма цистеина и некоторые другие аспекты метаболизма серы. Сплошными стрелками показаны основные пути биосинтеза, прерывистыми стрелками — более специализированные пути. Такими же стрелками показан ход процессов превращения метионина в цистеин и распада цистеина в тканях животных.
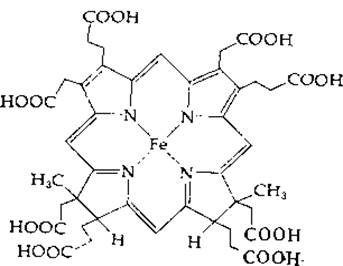
РИС. 14-16. Особый гем (сирогем), выделенный из сульфитредуктазы клеток Е. coli.
Некоторые стороны метаболизма неорганической серы уже обсуждались в гл. 10. Так, мы рассмотрели восстановление сульфата до H2S сульфатредуцирующими бактериями (гл. 10, разд. Е, 2, б). В растениях и в клетках Е. coli на пути ассимиляторного восстановления сульфата одной из начальных стадий также служит образование аденилилсульфата (стадия а, рис. 14-15; см. также уравнение (10-38)]. Сульфатредуцирующие бактерии способны восстанавливать аденилилсульфат непосредственно в сульфит [уравнение (10-38), стадия б], но у Е. coli путь ассимиляторного восстановления проходит через образование 3'-фосфо-5'-аденилилсульфата (PAPS); функция этого соединения как «активного сульфата» уже рассматривалась в гл. 11 (разд. Б, 3). Восстановление PAPS в сульфит (рис. 14-15, стадия г) осуществляется NADPH-зависимым ферментом.
Восстановление сульфита в сульфид у Е. coli катализируется сульфитредуктазой — крупным белком (мол. вес 670 000), в состав которого входят четыре молекулы связанного рибофлавинфосфата (FMN), четыре молекулы FAD, 20—21 атомов железа, 14—15 атомов лабильной серы и 3—4 молекулы особого гема [91]. Фермент использует NADPH в качестве восстановителя и передает электроны по собственной внутримолекулярной цепи переноса электронов на особый гем, содержащий тетрагидропорфирин типа изобактериохлорина (в нем восстановлены соседние пиррольные кольца; рис. 14-16) [92]. Этот ферментный белок, по-видимому, имеет следующий состав: a8ß4, где а — флавопротеид с мол. весом ∼54 000, а ß — гемсодержащий железо-серный белок с мол. весом ~60 000 [93]. Тот же путь обнаружен у Chlorella, однако более существенным у этой водоросли представляется другой путь восстановления сульфата [94]. Аденилилсульфат переносит свою сульфонильную группу на тиоловую группу переносчика [уравнение (14-37), стадия а].
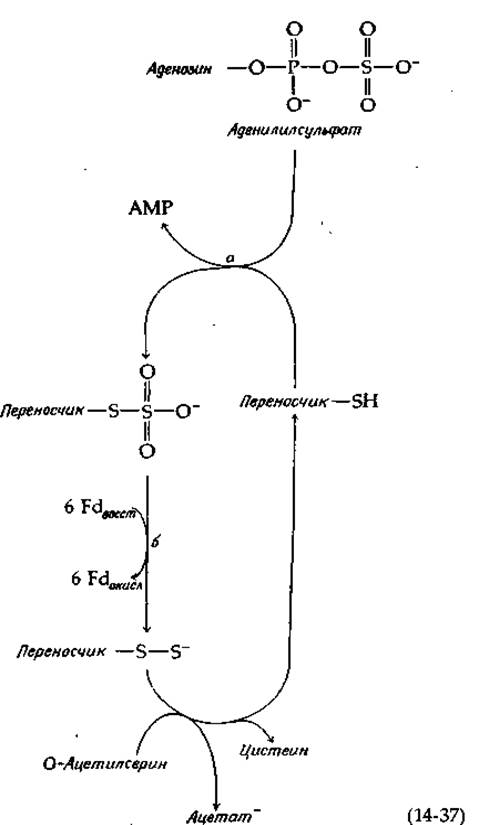
Образовавшийся тиосульфонат восстанавливается под действием ферредоксинзависимой редуктазы. Наконец, от —S—S--гpyппы восстановленного переносчика сульфидная группа переносится прямо в образующуюся молекулу цистеина путем реакции ß-замещения, аналогичной реакции, описываемой в следующем абзаце.
Цистеин образуется из сульфида и серина вслед за ацетилированием последнего путем переноса ацетильной группы ацетил-СоА (рис. 14-15, стадия е). Данная реакция представляет собой стандартную пиридоксальфосфатзависимую реакцию ß-замещения (рис. 8-7) и катализируется цистеинсиитетазой [94а]. Сходный фермент используется клетками некоторых микроорганизмов для образования гомоцистеина путем прямого введения сульфид-иона либо в О-сукцинилгомосерин, либо в О-ацетилгомосерин, как указано штриховыми стрелками в нижнем левом Углу рис. 14-15. Однако у Е. coli основной путь образования метионина, несомненно, проходит через цистатионин, как это отражено в уравнении (8-22) и указано сплошными стрелками на рис. 14-15 слева.
У животных важную роль играет обратный процесс — превращение Метионина в цистеин. Животные неспособны к образованию цистеина путем прямого включения сульфида, и поэтому цистеин должен либо поступать с пищей в готовом виде, либо образовываться из поступающего с пищей метионина. Последний процесс протекает в ограниченных масштабах, в связи с чем дети обязательно должны получать цистеин с пищей. Стадии образования цистеина из метионина показаны на рис. 14-15 вертикальными штриховыми стрелками. Последовательность реакций начинается с превращения метионина в S-аденозилметионин и далее в гомоцистеин в результате метаболического пути, показанного на рис. 14-9 (стадии г—е). Затем гомоцистеин реагирует с серином под действием цистатионин-β-синтетазы, а цистатионин распадается на цистеин и а-кетобутират под действием «у-расщепляющего фермента», присутствующего в тканях животных (рис. 14-9, внизу слева). Типы реакций представлены на рис. 8-7. Этот путь несколько сходен с идущим в обратном направлении процессом, описываемым уравнением (8-22).
Цистеин может подвергаться катаболизму или включаться в различные процессы биосинтеза. Простое расщепление цистеина, наблюдаемое у некоторых бактерий [95], состоит в пиридоксальфосфатзависимой реакции а,β-элиминирования с образованием H2S, пирувата и аммиака (рис. 14-15, реакция ж; рис. 8-6, реакция б). Другой путь заключается в переаминированни с образованием ß-меркаптопирувата (рис. 14-15, стадия з). Последний может быть расщеплен восстановительным путем на пируват и сульфид. Интересная ферментативная реакция ß-замещения (с участием пиридоксальфосфата) приводит к превращению цистеина в ß-цианаланин — присутствующий в некоторых растениях фактор, вызывающий у животных латиризм (дополнение 11-Б) [96].
Количественно важный путь катаболизма цистеина у животных связан с его окислением в цистеинсульфиновую кислоту (рис. 14-15, реакция и); это процесс двукратного гидроксилирования с использованием О2, NADPH или NADH и Fe2+. Цистеинсульфиновая кислота может далее быть окислена в цистеиновую кислоту, в результате декарбоксилирования которой образуется таурин. Последний является компонентом желчнокислых солей (рис. 12-16) и, возможно, играет роль нейромедиатора (гл. 16, разд. Б, 4). Таурин, вероятно, выполняет еще какую-то специфическую функцию в фоторецепторных клетках сетчатки. Для кошек он, по-видимому, является незаменимой аминокислотой [96а]. Таурин может быть восстановлен в изетионовую кислоту—компонент нервной ткани. Цистеиновая кислота может образоваться и другим путем — из О-ацетилсерина и сульфита (реакция м, рис. 14-15), а таурин может образоваться в результате декарбоксилирования цистеинсульфиновой кислоты в гипотаурин с последующим его окислением (реакция н).
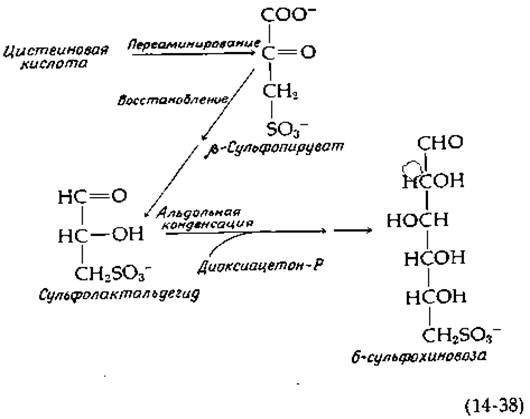
Интересным метаболическим процессом является протекающее в хлоропластах превращение цистеиновой кислоты в сульфолипид (рис. 2-32, табл. 13-2). Вероятная последовательность реакций начинается с переаминирования с образованием ß-сульфопирувата, который далее восстанавливается (предположительно в сульфолактальдегид), после чего происходит альдольная конденсация с диоксиацетонфосфатом, как указано в уравнении 14-38; изомеризация продукта приводит к 6-сульфохиновозе — сахару, входящему в состав сульфолипида [96b].
Возвращаясь к цистеинсульфиновой кислоте, отметим, что ее переаминирование дает ß-сульфинилпируват — соединение, легко теряющее SO2 в результате спонтанной реакции, аналогичной декарбоксилированию оксалоацетата (реакция n, рис. 14-15). У животных таков, вероятно, один из существенна путей отщепления серы из органических соединений. Однако для выведения из организма сульфит должен быть сперва окислен в сульфат. Фермент сульфитоксидаза относится к постепенно увеличивающейся группе белков, о которых известно, что они содержат молибден (дополнение 14-А). Сульфитоксидаза содержит также цитохром типа b5; электроны поступают от нее прямо на цитохром с в митохондриальной цепи переноса электронов. О том, сколь велико значение этого фермента для человека, свидетельствует сообщение о ребенке, не имевшем сульфитоксидазы, не выделявшем с мочой сульфатов и страдавшем тяжелыми неврологическими нарушениями [97].
Есть еще реакция, которая у животных обычно играет подчиненную роль, но может приобретать важное значение при недостатке сульфитоксидазы: окислительное слияние двух молекул сульфита в тиосульфат (реакция р, рис. 14-15). Тиосульфат участвует в одной интересной реакции — фермент со странным названием роданеза, найденный в печени, катализирует вытеснение сульфит-иона из молекулы тиосульфата цианид-ионом [уравнение (14-39)]. Реакция приводит к детоксикации цианид-ионов.
![]()
В тканях животных в небольших количествах содержатся органические гидросульфидные производные, в том числе тиоцистеин.

К этому же типу соединений относятся тиоглутатион и более окисленный тиотаурин. Тиоцистеин может появляться при действии цистатионинрасщепляющего фермента на цистин. В этой реакции элиминируется тиоцистеин, а из остающейся части молекулы цистина образуются пируват и аммиак.
Большая часть сульфата, образующегося в организме, без дальнейших изменений выводится с мочой, но значительная его доля этерифицируется олигосахаридами и фенольными соединениями. В этом случае, разумеется, используется перенос сульфонильной группы из PAPS [уравнение (11-4)]. Многие читатели (возможно ~40%) могли заметить, что после приема с пищей спаржи их моча приобретает характерный сильный запах. Такие генетические «скунсы» выделяют S-метилтиоакрилат и родственные соединения, но пока природа растительного метаболита, из которого эти продукты образуются, еще не установлена [98].
![]()