Биохимия - Химические реакции в живой клетке Том 3 - Д. Мецлер 1980
Метаболизм азотсодержащих соединений
Метаболизм ароматических соединений
Метаболизм фенилаланина и тирозина у растений
Некоторые пути метаболизма этих аминокислот, функционирующие у животных и бактерий, используются также и растениями. Однако у растений наиболее важную роль играют реакции, инициируемые фенилаланин — аммиак-лиазой и тирозин — аммиак-лиазой, рассматривавшимися в гл. 8, разд. Е, 5 [уравнение (8-36)]. На рис. 14-23 показан основной путь, ведущий к превращению этих двух аминокислот в транс-коричную кислоту и в ее моно-, ди- и триоксипроизводные. Циннамоил-СоА служит источником образования антоцианинов, а также других флавоноидных пигментов и полимерных конденсированных таннинов (дополнение 12-Б). Диокси- и триоксиметилированные продукты являются исходным материалом для образования лигнинов. Кроме того, на этом рисунке изображено много других продуктов, обусловливающих характерный запах некоторых растений, а также различных специй. Следует, однако, заметить, что протокатехат, являющийся также продуктом бактериального катаболизма (рис. 14-22), в растениях образуется путем простого расщепления 5-дегидрошикимата (рис. 14-17) с последующей енолизацией. Гидроксилирование протокатехината ведет к образованию галлата, который в виде эфиров или других производных входит в состав «гидролизуемых таннинов». Эти вещества накапливаются в вакуолях растений, а также откладываются в коре вместе с «конденсированными таннинами», полимерными флавоноидными соединениями (дополнение 12-Б) [135].


РИС. 14-23. Образование некоторых метаболитов фенилаланина и тирозина у растении.
Лигнин представляет собой материал очень сложного состава с мол. весом более 10 000. Он на редкость устойчив и не растворяется даже в горячей 70 %,-ной серной кислоте. Лигнин часто описывают как «статистический полимер. построенный из оксифеиилпропановых звеньев». Он образуется путем окислительной конденсации кониферилового спирта (рис. 14-23) и родственных мономеров [137—139]. Ферментом, ответственным за полимеризацию, может быть пероксидаза, катализирующая образование лигнина из мономерных спиртов и Н2О2. Радикал, образующийся при удалении электрона из фенолят-аниона кониферилового спирта, существует во множестве резонансных состояний, в которых неспаренный электрон может локализоваться не только на кислороде, но и в положениях, отмеченных на приводимой ниже структуре звездочками:
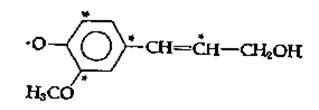

РИС. 14-24. Предполагаемая структура букового лигнина. Имеется 25 различных С9-звеньев; некоторые из них могут быть с той или иной степенью вероятности заменены тремя димерными структурами, приведенными в скобках [139].
Конденсация таких радикалов дает начало великому множеству соединений. Например, в. результате димеризации образуется устойчивая структура с эфирными связями, приведенная в уравнении (14-46).
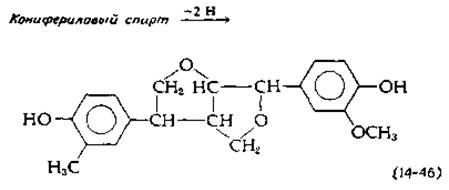
Образующийся димер все еще содержит гидроксильные группы, способные к переходу в радикалы и присоединению следующих звеньев. Имеется еще не менее десяти других типов межмолекулярных связей (рис. 14-24). Лигнин представляет исключительную ценность как потенциальный источник сырья, используемого для промышленного получения ароматических соединений. Однако пока в его утилизации существенных успехов не достигнуто.
Окислительное разрушение лигнина приводит к образованию гуминовых кислот, являющихся важным органическим компонентом почв [138].
Алкалоиды [140, 141]
Идентифицировано свыше 2500 алкалоидов — различных азотсодержащих соединений, образующихся у растений. Особенно много различных алкалоидов образуется у растений определенных семейств. Алкалоиды часто рассматривают как конечные продукты азотистого метаболизма у растений. Однако большинство растений вообще не содержит алкалоидов, и тот факт, что у некоторых растений они образуются, возможно, связан с экологическими причинами. Многие алкалоиды обладают биологической активностью — оказывают выраженное действие на организм животных.
Значительная часть алкалоидов образуется непосредственно из ароматических аминокислот. Впервые это установил Робинсон [141, а, b) в 1917 г. Робинсон предположил, что алкалоиды могут синтезироваться в результате реакций Манниха из аминов и альдегидов. В реакции Манниха [уравнение (14-47)] амин и альдегид (вероятно, образуя шиффово основание) реагируют с нуклеофильным углеродом, таким, как углерод енолят-аниона. Декарбоксилирование аминокислот может привести к появлению различных аминов, а альдегиды могут быть образованы окислительным декарбоксилированием аминокислот (проходящим через переаминирование и а-декарбоксилирование). Таким образом, аминокислоты могут дать начало обоим главным реагентам, используемым в синтезе алкалоидов. Далее нуклеофильные центры ароматических колец в частности находящиеся в пара-положении относительно гидроксильных заместителей, часто участвуют в конденсации Манниха. Подобный пример приведен на рис. 14-25. ДОФА декарбоксилируется, превращаясь в дофамин, который окисляется в 3,4-диоксибензальдегид. Реакция Манниха (через показанное на рисунке образование шиффова основания) приводит к циклизации. В результате окисления цикла образуется изохинолиновое ядро — характерный структурный элемент большой группы алкалоидов. Метилирование приводит к образованию папаверина, образующегося в снотворном маке. Родственный ему алкалоид морфин (рис. 14-25) на первый взгляд не имеет с ним никакого сходства. Однако при более внимательном подходе можно предложить прямой путь биосинтеза морфина. По существу это путь такой же конденсации, которая ведет к образованию папаверина, но в данном случае вместо дофамина используется тирамин. Далее Два цикла окислительно конденсируются посредством одной связи С—С и одной эфирной связи.
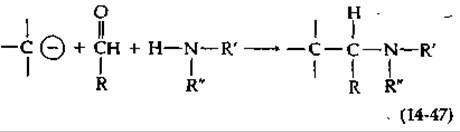
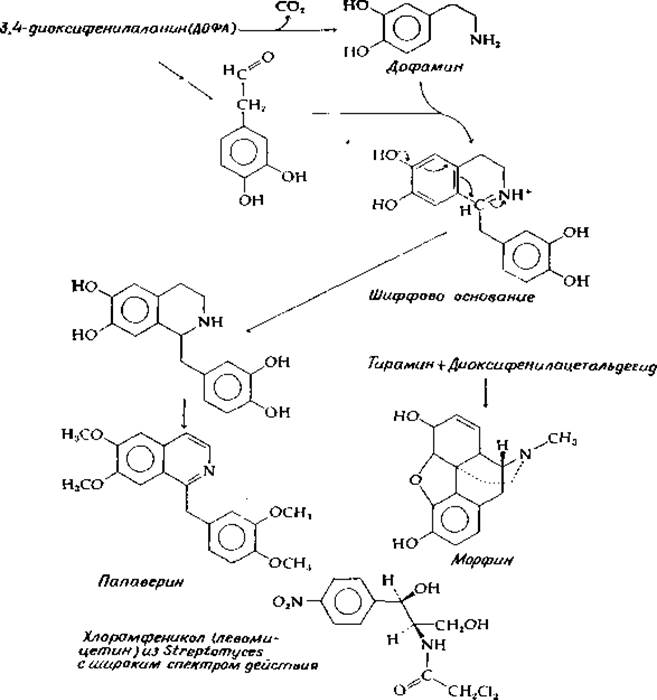
РИС. 14-25. Образование нескольких алкалоидов н других соединений из промежуточных метаболитов тирозина.
Хотя идеи Робинсона о биосинтезе алкалоидов первоначально носили чисто умозрительный характер, затем они нашли экспериментальное подтверждение в опытах с использованием изотопных меток. Тем не менее остается много нерешенных вопросов. Среди промежуточных соединений не оказалось постулированных альдегидов. Можно думать, что конденсация Манниха происходит при участии кетокислот, предшествуя декарбоксилированию.
Еще одним алкалоидом, происходящим из фенилаланина и тирозина, является колхицин (дополнение 4-А). Шестичленное кольцо получается из фенилаланина, а семичленный трополоновый цикл образуется путем расширения ядра тирозина.