Биохимия - Химические реакции в живой клетке Том 3 - Д. Мецлер 1980
Метаболизм азотсодержащих соединений
Метаболизм триптофана и синтез NAD
Биосинтез триптофана, обрисованный в общих чертах на рис. 14-15 обсуждался в разд. 3,3. Его катаболизм в тканях животных показан схематически на рис. 14-26. Один ряд реакций (начинающийся со стадии а) осуществляется бактериями кишечника. Индол, получающийся путем ß-элиминирования, гидроксилируется и превращается в индоксил. Последний частично поступает в кровь и экскретируется с мочой в видоиндоксилсульфата. В клетках животных основной катаболический пут триптофана начинается (стадия б, рис. 14-26) с действия триптофан -2,3-диоксигеназы [уравнение (10-45)]. Этот фермент был предметом интенсивных исследований, что объясняется его индуцибельностью в тканях животных, а также тем обстоятельством, что он подвержен гормональной регуляции. Индуцирующими агентами служат как триптофан, так и глюкокортикоиды [17, 142].
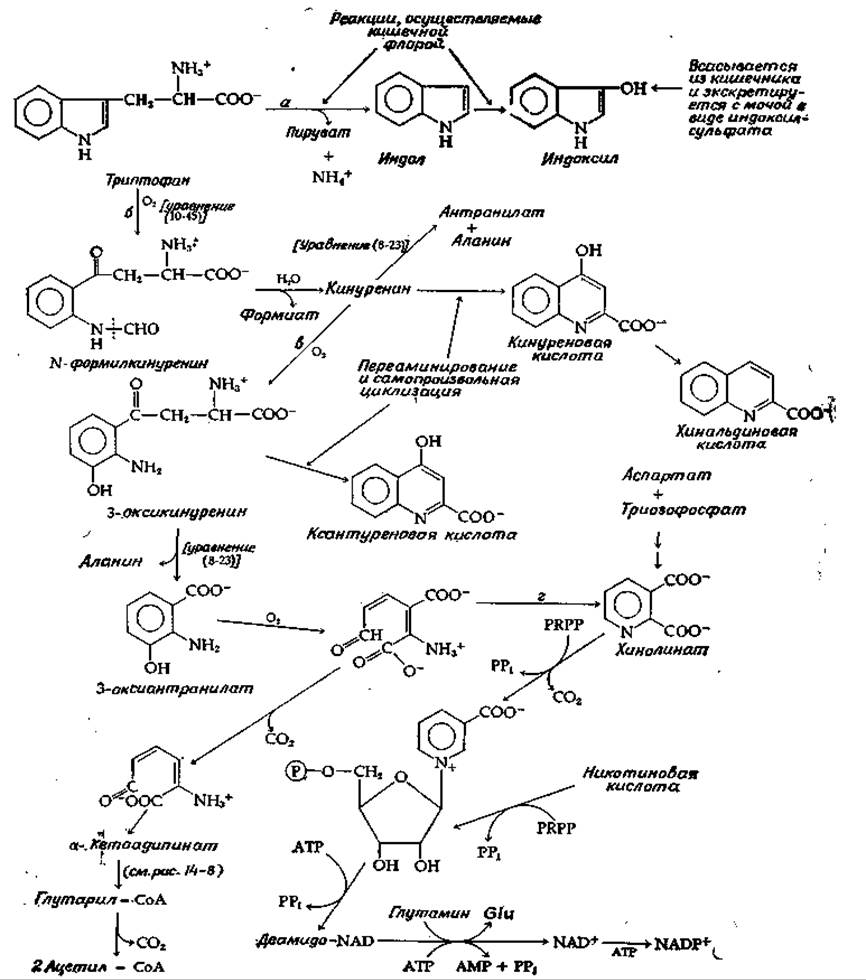
РИС. 14-26. Некоторые реакции катаболизма триптофана и реакции, ведущие к синтезу NAD и NADP.
Гидролитическое удаление формиата из продукта действия триптофандиоксигеназы приводит к образованию кинуренина — соединения, на которое могут действовать несколько ферментов. Кинурениназа [уравнение (8-23)] расщепляет его на антранилат и аланин, а переаминирование приводит к образованию циклической кинуреновой кислоты. Последняя в результате необычной реакции отщепления гидроксила превращается в хинальдиновую кислоту, один из главных продуктов, экскретируемых с мочой.
Другой существенный путь метаболизма кинуренина состоит в его гидроксилировании с превращением в 3-оксикинуренин (стадия в, рис. 14-26), который может подвергаться переаминированию с образованием циклической ксантуреновой кислоты или же расщеплению кинурениназой с образованием 3-оксиантранилата. В последнем под действием диоксигеназы происходит размыкание цикла с последующим распадом до глутарил-СоА, как указано на рисунке. У животных функционирует и другой путь, имеющий существенное значение для питания. Альдегид, образующийся в реакции дециклизации, может вновь замкнуться (стадия г) в пиридиновое ядро хинолиновой кислоты. Последняя в ходе реакции, сопровождающейся декарбоксилированием, соединяется с фосфорибозильной группой молекулы PRPP, образуя мононуклеотид никотиновой кислоты. Аденилилирование дает дезамино-NAD, который превращается в NAD путем аминирования карбоксильной группы за счет глутамина.
Как показано на рис. 14-26, для формирования NAD может быть использована и свободная никотиновая кислота. Неудивительно, что в качестве источника NAD никотиновая кислота, относящаяся к числу обязательных витаминов, примерно в 60 раз эффективнее триптофана. Тем не менее рацион с высоким содержанием триптофана частично компенсирует недостаточное поступление никотиновой кислоты с пищей. Тот факт, что рацион, в котором единственным источником белка служит маис, вызывает развитие пеллагры (одна из форм авитаминозов; Дополнение 8-3), частично объясняется низким содержанием триптофана в данном белке. У растений, по-видимому, существует другой путь синтеза хинолината — из аспартата и триозофосфата, — который служит основным способом природного синтеза никотиновой кислоты.
Триптофан служит предшественником множества алкалоидов и других метаболитов. Некоторые из них приведены на рис. 14-27. Алкалоид гармин, обнаруженный в растениях некоторых семейств, может образовываться из триптофана и ацетальдегида (или пирувата) тем же Путем, какой показан на рис. 14-25 для образования папаверина.
Гидроксилирование триптофана приводит к 5-окситриптофану, который путем декарбоксилирования превращается в серотонин, важный Нейромедиатор. Серотонин встречается как у растений, так и у животных. Он может подвергаться ацетилированию и метилированию в мелатонин — гормон эпифиза (рис. 14-27). Некоторые характерные растительные метаболиты получаются непосредственно из серотонина; в частности, таким путем в грибах Psilocybe aztecorum образуется псилоцибин — вещество, вызывающее галлюцинации. Важный гормон растений индолил-3-ацетат (ауксин) предположительно получается путем окислительного декарбоксилирования а-кетокислоты, соответствующей триптофану. Промежуточным соединением может служить соответствующий альдегид. Продукт его восстановления индолил-3-этанол также присутствует в растениях и является активным метаболитом [142а]. Многие годы алкалоид грамин из ячменя рассматривали как биохимический курьез, поскольку в его молекуле атом азота отделен от индольного кольца только одним атомом углерода. Теперь его считают продуктом распада триптофана, происходящего в результате PLP-зависимой реакции, сходной с реакцией, катализируемой серии-трансоксиметилазой (гл. 8, разд. Д, 3, в; рис. 14-27). Другие алкалоиды образуются более традиционными путями. Конденсация изопентильной группы с индольным ядром триптамина лежит в основе образования лизергиновой кислоты. Индольное кольцо триптофана можно отчетливо различить в структуре резерпина из Rauwolfia; это соединение представляет большой интерес для медицины, поскольку оно понижает кровяное давление, освобождая нервные ткани от избытка серотонина, дофамина и норадреналина. Резерпин содержит еще и бензольное кольцо, образующееся из триптофана в процессе, проходящем через расширение кольца.
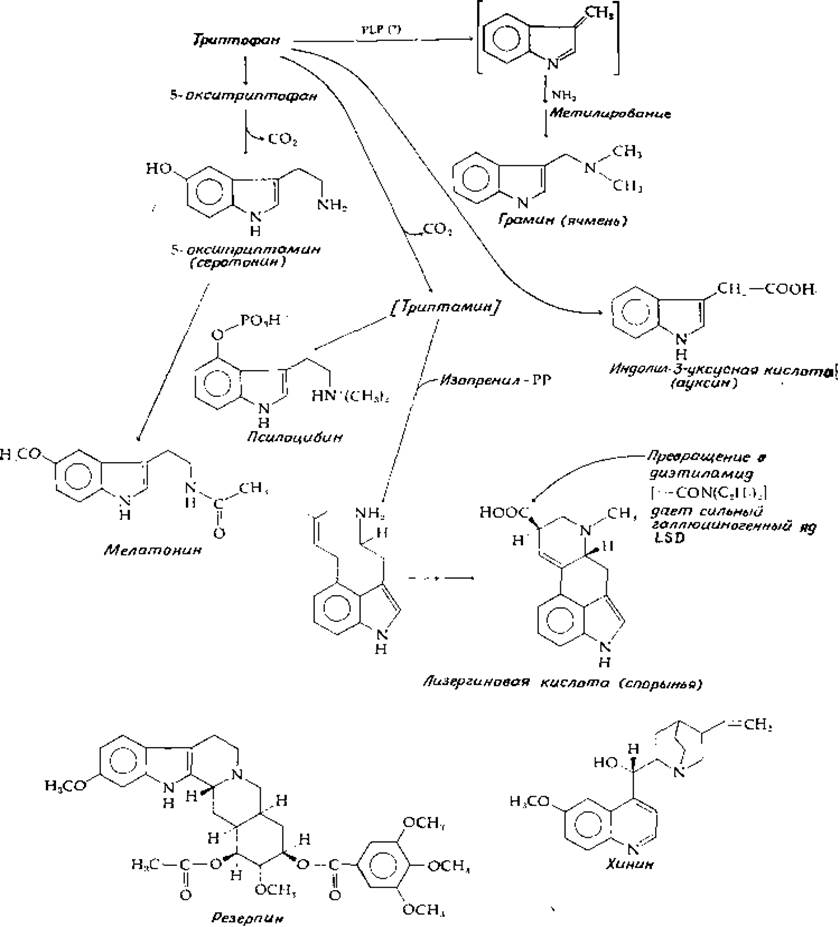
РИС. 14-27. Структура и пути биосинтеза некоторых нидолсодержащих алкалоидов и других продуктов метаболизма триптофана.