ОСНОВЫ БИОХИМИИ И МОЛЕКУЛЯРНОЙ БИОЛОГИИ - Н. Н. Скворцова - 2016
Часть I. Химические компоненты клетки
1. АМИНОКИСЛОТЫ, ПЕПТИДЫ, БЕЛКИ
Белки, или протеины, - это высокомолекулярные полимеры биогенного происхождения, состоящие из аминокислот, соединенных пептидными связями. Белки относятся к высокомолекулярным соединениям, в состав которых входят сотни и тысячи аминокислотных остатков, объединенных в макромолекулярную структуру.
1.1. Строение, классификация и физико-химические свойства протеиногенных аминокислот
Протеиногенными называются а, L-аминокислоты, включающиеся в состав белковых молекул в процессе биосинтеза. Протеиногенные аминокислоты называют исторически сложившимися тривиальными названиями (табл. 1).
Таблица 1. Протеиногенные α, L-аминокислоты млекопитающих
Название |
Структурная формула* |
Обозначение |
|
русское |
международное |
||
Глицин |
NH2-CH2-COOH |
Гли |
Gly, G |
Аланин |
CH3-CH(NH2)-COOH |
Ала |
Ala, A |
Валин** |
(CH3)2CH-CH(NH2)-COOH |
Вал |
Val, V |
Лейцин* * |
CH3-CH(CH3)-CH2-CH(NH2)-COOH |
Лей |
Leu, L |
Изолейцин* * |
CH3-CH2-CH(CH3)-CH(NH2)-COOH |
Иле |
Ile, I |
Серин |
HO-CH2-CH(NH2)-COOH |
Сер |
Ser, S |
Треонин** |
CH3-CH(OH)-CH(NH2)-COOH |
Тре |
Thr, T |
Цистеин |
HS-CH2-CH(NH2)-COOH |
Цис |
Cys, C |
Метионин** |
CH3-S-(CH2)2-CH(NH2)-COOH |
Мет |
Met, M |
Лизин** |
NH2-CH2-CH2-CH2-CH2-CH(NH2)-COOH |
Лиз |
Lys, K |
Аргинин*** |
NH2-C(=NH)-NH-(CH2)3-CH(NH2)-COOH |
Арг |
Arg, R |
Аспарагиновая кислота |
COOH-CH2-CH(NH2)-COOH |
Асп |
Asp, D |
Аспарагин |
NH2-C(=O)-CH2-CH(NH2)-COOH |
Асн |
Asn, N |
Глутаминовая кислота |
HOOC-CH2-CH2-CH(NH2)-COOH |
Глу |
Glu, E |
Глутамин |
NH2-C(=O)-CH2-CH2-CH(NH2)-COOH |
Глн |
Gln, Q |
Фенил-аланин** |
C6H5-CH2-CH(NH2)-COOH |
Фен |
Phe, F |
Тирозин |
p-HO-C6H4-CH2-CH(NH2)-COOH |
Тир |
Tyr, Y |
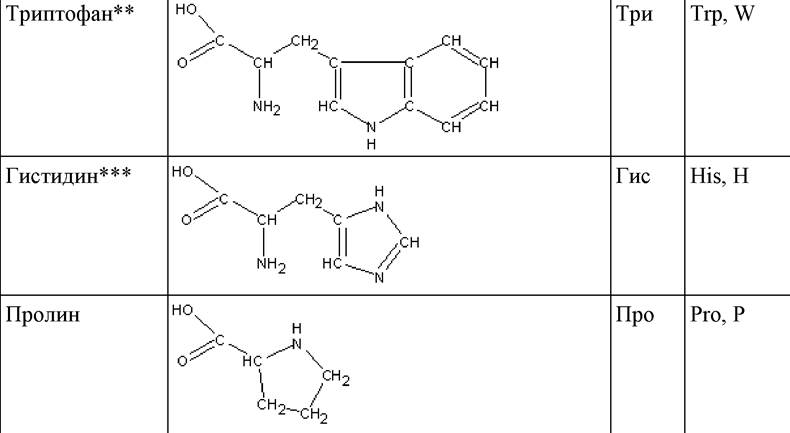
* Боковые радикалы R выделены жирным шрифтом.
** Незаменимые аминокислоты.
*** Условно незаменимые аминокислоты.
Таким образом, известно 20 протеиногенных аминокислот, 19 из которых имеют общую формулу, включающую карбоксильную группу, аминогруппу, асимметрический атом углерода, водород и боковой радикал R. Двадцатая аминокислота (пролин), по существу, является иминокислотой и представляет собой пятичленный гетероцикл. Определяет аминокислоту строение бокового радикала R, поскольку остальная часть молекулы для всех протеиногенных аминокислот совершенно одинакова. На этом основана классификация аминокислот по строению бокового радикала R (табл. 2).
Таблица 2. Классификация аминокислот по строению бокового радикала R
Полярность аминокислот |
Химический состав |
Перечень аминокислот |
Неполярные гидрофобные |
Моноаминомонокарбоновые |
Глицин, лейцин, изолейцин, валин, аланин, фенилаланин |
Полярные незаряженные |
Моноаминомонокарбоновые |
Серин, треонин, тирозин, метионин, цистеин, аспарагин, глутамин |
Положительно заряженные (основные) |
Диаминомонокарбоновые |
Лизин, аргинин, триптофан |
Отрицательно заряженные (кислые) |
Моноаминодикарбоновые |
Аспарагиновая кислота, глутаминовая кислота |
Аминокислоты являются амфотерными соединениями (амфолитами): в щелочных средах они образуют соли карбоновых кислот, в кислых - аммонийные соли:
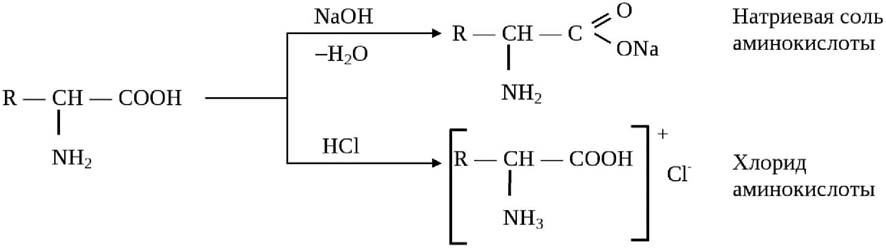
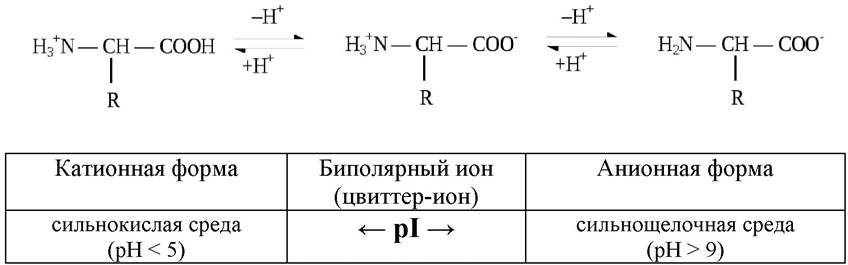
На диссоциацию аминокислот оказывает влияние pH среды. В очень кислых растворах аминогруппа протонирована полностью, а карбоксильная группа практически не ионизирована. В сильнощелочных растворах - наоборот: при значениях pH от 4 до 9 каждая из диссоциирующих групп находится в равновесии со своей неионизированной формой, а обе группы вместе находятся в равновесии с биполярным ионом (цвиттер-ионом). Если сумма зарядов на аминокислоте равна нулю, такое значение рН носит название изоэлектрической точки и обозначается pI (рис. 4).
Рис. 4. Кислотно-основные свойства аминокислоты при различных значениях рН
Еще одним проявлением амфотерности является способность аминокислот образовывать в щелочной среде с сульфатом меди ярко окрашенные растворимые комплексные соединения с ионом меди Cu2+:
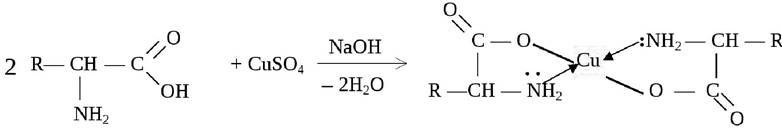
Эта реакция лежит в основе биуретового метода качественного и количественного определения белков.
При взаимодействии α-аминогруппы одной аминокислоты с α-карбоксильной группой другой аминокислоты образуются пептидные связи. Так формируется остов молекулы белка. Главная структурная единица белков и пептидов - пептидная связь (рис. 5).
Рис. 5. Схема образования пептидной связи
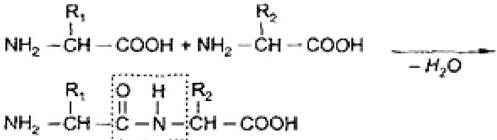
Пептидная связь имеет плоскостную структуру: атомы С, О и N находятся в sp2 -гибридизации; у атома N имеется p-орбиталь с неподеленной парой электронов; образуется p-π-сопряженная система, приводящая к укорочению связи C-N (0,132 нм). Это вызвано различной электроотрицательностью атомов С, N и O.
Связанные пептидной связью аминокислоты образуют полипептидную цепь. Вокруг пептидной связи вращение невозможно, все четыре атома лежат в одной плоскости, т. е. компланарны. Вращение же других связей вокруг полипептидного остова достаточно свободно. Пептидная связь имеет преимущественно транс-конфигурацию относительно плоскости пептидной связи. Строение пептидной связи проявляется в формировании вторичной и третичной структуры белка.
Пептидная связь устойчива при температурах ниже 40 °C в нейтральной среде, при более высоких температурах в кислой или щелочной среде пептидная связь может гидролизоваться.
1.2. Пептиды
Пептиды - природные или синтетические соединения, молекулы которых построены из остатков α-аминокислот, соединенных пептидными (амидными) связями. Пептиды содержатся в составе биологических тканей наряду с белками. Пептиды могут содержать непротеиногенные аминокислоты, аминокислоты D-ряда.
По числу аминокислотных остатков, входящих в молекулы пептидов, различают дипептиды, трипептиды, тетрапептиды и т. д. Пептиды, содержащие до десяти аминокислотных остатков, называются олигопептидами, содержащие более десяти аминокислотных остатков - полипептидами.
Название пептида образуется из названий входящих в его состав аминокислотных остатков, перечисляемых последовательно начиная с N-концевого. При этом используют тривиальные названия аминокислот, в которых суффикс «ин» заменяется на «ил». Исключение составляет C-концевой остаток, название которого совпадает с названием соответствующей аминокислоты. Все аминокислотные остатки, входящие в пептиды, нумеруются начиная с N-конца. Для записи первичной структуры пептида (аминокислотной последовательности) широко используют трех- и однобуквенные обозначения аминокислотных остатков (табл. 3). Например, пентапептид Pro-Ser- Phe-Tyr-Gly - это пролил-серил-фенилаланил-тирозил-глицин (в однобуквенном обозначении: PSFYG).
Многие пептиды обладают специфическим действием и высокой биологической активностью.
Глутатион - трипептид y-глутамилцистеинилглицин - содержится во всех животных, растительных и бактериальных клетках (рис. 6):
Рис. 6. Восстановленная (А) и окисленная (Б) формы глутатиона
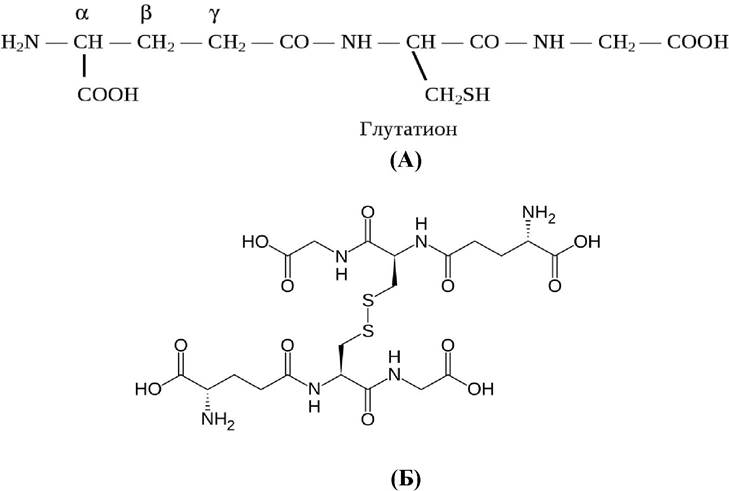
Глутатион является активатором тиоловых ферментов. Входит в систему антиоксидантной защиты клетки благодаря возможности существования в восстановленной (А) и окисленной (Б) формах.
Карнозин - дипептид β-аланил-L-гистидин обнаружен в высоких концентрациях в мышцах и тканях мозга:
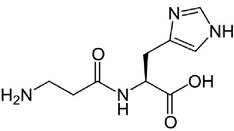
Активность карнозина проявляется в удалении сильных окислителей - активных форм кислорода и ненасыщенных альдегидов, образующихся из суперокисленых жирных кислот клеточных мембран. По современным представлениям, дипептид препятствует повреждению клеток в результате окислительного стресса.
К пептидам относятся эндорфины и энкефалины коры головного мозга, гормоны задней доли гипофиза - окситоцин и вазопрессин, группа регуляторных пептидов желудочно-кишечного тракта - секретины и гастрины, антибиотик грамицидин, токсин грибов фаллоидин.
1.3. Белки
1.3.1. Элементный состав и молекулярная масса белков
Белки обязательно содержат пять элементов: азот, углерод, кислород, водород и серу. Содержание элементов в разных белках колеблется в следующих пределах: углерода - 51-55 %; кислорода - 21,5-23,5 %; водорода - 6-7 %; азота - 15-17,6 %; серы - 0,3-2,5 %. Отличие в содержании серы объясняется тем, что она входит в состав серосодержащих аминокислот (метионин, цистеин), наличие которых в разных белках различно.
Среднюю величину содержания азота в белках (16 %) используют для расчета поступления белков с пищей и определения расхода белков организмом. Суммарное поступление азота с пищей или величину его выведения из организма в составе азотсодержащих конечных продуктов обмена можно также определить, вычислив количественное поступление или расход белка организмом. Для этого азот пищи или конечных продуктов обмена умножают на коэффициент 6,25 (100/16 = 6,35). Например, 15 г азота конечных продуктов обмена соответствует 93,75 г белка.
В состав некоторых белков входят фосфор, железо, медь, цинк, йод и некоторые другие элементы.
1.3.2. Структурная организация белковой молекулы
Молекулярная масса белков колеблется от 6000 (нижний предел) до 1000000 и выше в зависимости от количества отдельных полипептидных цепей в составе единой молекулярной структуры белка. Такие полипептидные цепи называются субъединицами. Их молекулярная масса варьирует в широких пределах: от 6000 до 100000 и более.
Для выражения молекулярной массы белков используют также специальную единицу - дальтон. Дальтон (D) - единица массы, практически равная массе атома водорода (т. е. 1,0000 по шкале атомных масс). Терминами «дальтон» и «молекулярная масса» пользуются как взаимозаменяемыми: например, белок в 20000 дальтон имеет молекулярную массу 20000. Наименование дано в честь Джона Дальтона, разработавшего атомарную теорию строения материи. Килодальтон (кDа) - единица массы, равная 1000 дальтон. Масса большинства белков лежит в пределах от 10 до 100 kDа.
Белки имеют сложную структурную организацию, включающую четыре уровня.
Первичная структура белка - состав и последовательность аминокислотных остатков полипептидной цепи молекулы. Состав цепи определяется боковыми группами аминокислот (R), окружающими остов молекулы (рис. 7):
Рис. 7. Первичная структура белка
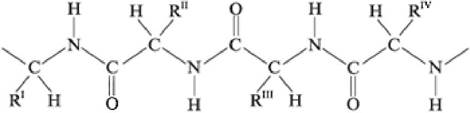
Полипептидная цепь имеет определенное направление. Изображение последовательности аминокислот в цепи начинается с N-концевой аминокислоты (N-конец пептидной цепи) и завершается свободной α-карбоксильной группой С-концевой аминокислоты (С-конец пептидной цепи). С N-конца начинается нумерация аминокислотных остатков (рис. 8):
Рис. 8. Направленность пептидной цепи трипептида
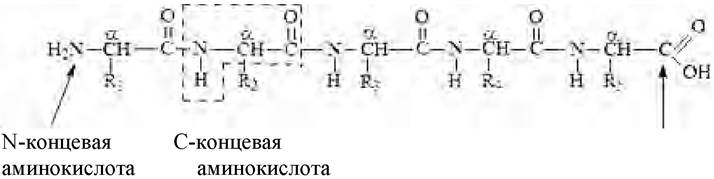
Для определения С-концевой аминокислоты часто используют ферментативные методы.
Последовательность аминокислот в белке уникальна и детерминируется генами. Небольшие изменения первичной структуры могут серьезно изменять свойства белка. В природных белках варьируются длина и состав цепи. Потенциально возможное число таких структур практически неограниченно. Из 20 аминокислот можно построить 2015вариантов пептидных последовательностей, содержащих 15 аминокислотных остатков.
Первичная структура белка обусловливает уникальность пространственной организации белковой молекулы.
Вторичная структура белка определяет возможные формы расположения полипептидной цепи в пространстве в виде α-спирали или β-складчатой структуры. Основную роль в поддержании вторичной структуры играют водородные связи, возникающие между С=О и NH-группами остова пептидной цепи (рис. 9).
Рис. 9. Элементы вторичной структуры белка: а - параллельная; б - антипараллельная; в - β-структура, правая α-спираль
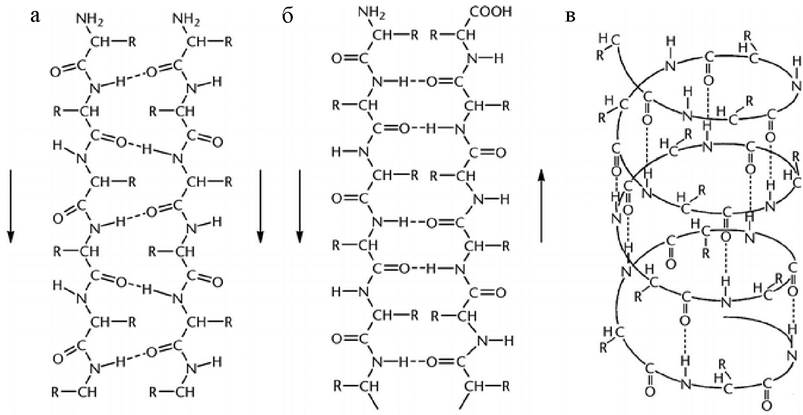
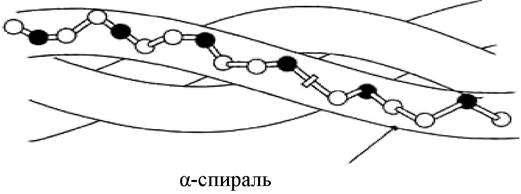
Наиболее распространенным элементом вторичной структуры является правая α-спираль (рис. 9, в). Образование α происходит по часовой стрелке (правый ход спирали), так как природные белки состоят из L-аминокислот. Ha каждый виток приходится 3,6 аминокислотного остатка (шаг винта), минимальное расстояние между двумя эквивалентными точками составляет 0,54 нм. α-Спираль стабилизируется водородными связями между NH-группой одного остатка аминокислоты и CO-группой четвертого от нее остатка. Таким образом, в протяженных спиральных участках каждый аминокислотный остаток принимает участие в формировании двух водородных связей. Спиральное расположение остова образует подобие цилиндра, причем боковые радикалы аминокислотных остатков оказываются на наружной поверхности, обеспечивая ее гидрофобную или гидрофильную природу.
α-Спираль встречается в белках очень часто: кератин волос и шерсти - полностью спиральный белок, в гемоглобине и миоглобине содержание α-спирали 75 %. В то же время есть белки, в которых содержание α-спиральных участков невелико. Так, в ферменте рибонуклеазе доля α-спирали составляет 17 %.
Другая форма спирали присутствует в коллагене - важнейшем компоненте соединительных тканей. Это левая спираль коллагена с шагом 0,96 нм, имеющая 3,3 аминокислотных остатка в каждом витке. Спираль коллагена более пологая, и в отличие от α-спирали образование водородных мостиков здесь невозможно. Структура коллагена стабилизирована за счет скручивания левых спиралей трех пептидных цепей в правую тройную спираль (рис. 10).
Рис. 10. Схема структуры коллагена
В отличие от α-спирали участки β-складчатой структуры почти полностью вытянуты и могут располагаться как параллельно (рис. 9, а), так и антипараллельно (рис. 9, б). β-Структура стабилизируется межцепочечными водородными связями между соседними участками одной и той же полипептидной цепи. Водородные связи слабые (энергия водородной связи 5-10 ккал/моль, в то время как, например, энергия ковалентной связи О-Н равна 109 ккал/моль). Однако большое количество водородных связей обеспечивает стабильность белковой молекулы (кумулятивный эффект).
В полипептидных цепях, кроме регулярных структур, есть и нерегулярные вторичные структуры. Однако конформация этих участков также строго обусловлена первичной аминокислотной последовательностью, т. е. структура биологически активного белка строго упорядочена и не является хаотичной.
Третичная структура белка - форма белковой молекулы в трехмерном пространстве. Третичная структура белка определяет общее расположение полипептидной цепи в пространстве в относительно компактную систему, в которой элементы вторичной структуры взаимодействуют между собой и с участками неупорядоченной структуры, образуя глобулу - глобулярные белки (рис. 11) или вытянутое волокно - фибриллярные белки (рис. 12).
Рис. 11. Схема глобулярной пространственной структуры
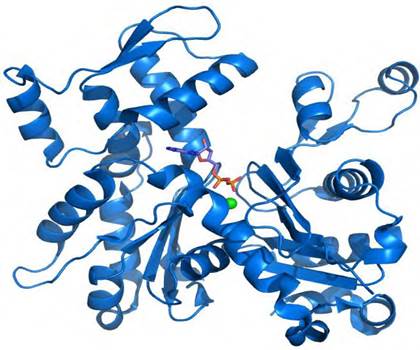
Рис. 12. Схема фибриллярной пространственной структуры
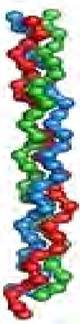
На рисунках участки альфа-спирализованной полипептидной цепи принято обозначать в виде цилиндров (или в виде спиралей), а участки β-структур - в виде стрелок.
Третичная структура возникает в результате самоорганизации полипептидной цепи.
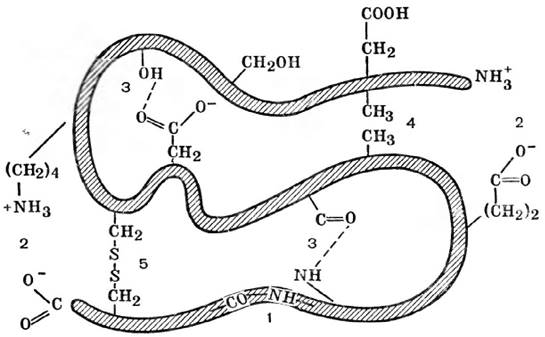
Существует несколько видов стабилизирующих взаимодействий между боковыми функциональными R-группами аминокислот, в основном нековалентного характера: электростатические силы притяжения между R-группами, несущими противоположно заряженные ионогенные группы (ионные связи); гидрофобные взаимодействия между неполярными (гидрофобными) R-группами; дисульфидные связи, образующиеся при сближении двух молекул цистеина с последующим окислением и образованием дисульфидного мостика (рис. 13).
Рис. 13. Схема связей, стабилизирующих третичную структуру молекулы белка: 1 - ковалентная пептидная связь; 2 - электростатическое взаимодействие между ионизированными карбоксильной и аминогруппой боковых радикалов; 3 - водородная связь; 4 - гидрофобное взаимодействие; 5 - дисульфидный мостик (ковалентная связь между боковыми тиольными группами цистеина)
Четвертичная структура характерна для белков с молекулярной массой более 60 000 D, построенных из двух или более полипептидных цепей (субъединиц, протомеров). Субъединицы могут быть как одинаковыми, так и разными, их взаимодействие осуществляется с высокой специфичностью. Практически все белки-ферменты имеют четвертичную структуру и состоят, как правило, из четного числа протомеров (двух, четырех, шести, восьми).
При этом каждая полипептидная цепь (субъединица) сохраняет присущую ей первичную, вторичную и третичную структуру. Такая молекула представляет собой единое целое и выполняет биологическую функцию, не свойственную каждой субъединице в отдельности.
Четвертичная структура белка закрепляется с помощью ионных, водородных и ван-дер-ваальсовых сил между контактными поверхностями субъединиц, благодаря чему ошибки при формировании четвертичной структуры белков исключены.
Таким образом, в первичной структуре пептидной последовательности закодированы два уровня: 1) трехмерная структура отдельных полипептидных цепей и 2) четвертичная структура всей многокомпонентной молекулы, так как каждая субъединица содержит специфические участки для контакта с другими субъединицами.
Характерной особенностью белков с четвертичной структурой является их способность к самосборке. Легко, например, происходит самосборка гемоглобина из смеси α- и β-цепей. Четыре полипептидные цепи гемоглобина ассоциированы в тетраэдрическую структуру и образуют сферическую молекулу (рис. 14).
Рис. 14. Схема четвертичной структуры молекулы гемоглобина, состоящей из четырех попарно одинаковых субъединиц (двух α-цепей и двух в-цепей), каждая из которых содержит гем

Преобладающая форма гемоглобина у взрослых людей - гемоглобин А - имеет две пары полипептидных цепей (а-цепей, каждая из которых состоит из 141 аминокислотного остатка, и β-цепей - по 146 остатков в каждой). Каждая из α-цепей контактирует с двумя β-цепями, в то время как между двумя α-цепями или между двумя β-цепями взаимодействие почти отсутствует. Гемы занимают гидрофобные полости внутри свернутых полипептидных цепей.
Каждый из четырех гемов гемоглобина содержит Fe2+ и способен присоединить одну молекулу кислорода. Кислородсодержащая форма гемоглобина называется оксигемоглобином, а форма, не содержащая кислорода, - дезоксигемоглобином. Когда дезоксигемоглобин поглощает кислород, в его трехмерной структуре происходит ряд структурных изменений. Окисление Fe2+ до Fe3+ приводит к образованию неактивной формы гемоглобина - метгемоглобина, который неспособен присоединять молекулярный кислород. Сродство гемоглобина к окиси углерода больше, чем к кислороду; следовательно, СО может вытеснять кислород из оксигемоглобина. Образующийся карбоксигемоглобин неспособен служить переносчиком кислорода, и поэтому окись углерода является эффективным ядом.
Способность обратимо образовывать комплексы с кислородом обусловливает жизненно важную роль гемоглобина как переносчика кислорода у животных.
1.3.3. Денатурация и ренатурация белков
Одно из фундаментальных свойств белка - способность к денатурации. Денатурация - это нарушение нативной (природной) структуры белка, вызываемое действием физических и химических факторов и приводящее к изменению физико-химических свойств и утрате биологических функций-структурной, транспортной, каталитической и др. (рис. 15).
Рис. 15. Денатурация и ренатурация белковой молекулы
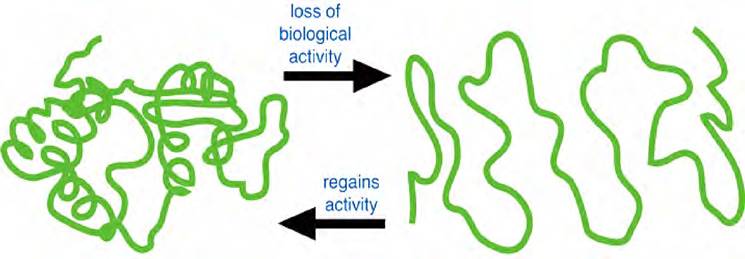
Первичная структура денатурированных белков не изменяется, но пептидные связи становятся более доступными действию протеолитических ферментов. В сложных белках при денатурации ослабляются связи с простетическими группами. Денатурированные белки хуже растворяются в воде, чем нативные.
Денатурация вызывается высокими температурами - нагреванием раствора белка до 60-80 °С, действием низких и высоких значений рН, интенсивным перемешиванием растворов белка или встряхиванием, действием поверхностно-активных полярных веществ - мочевины, гуанидинхлорида, меркаптоэтанола.
Из физических факторов денатурирующее действие на белковую молекулу оказывают: высокое давление, излучения различной частоты и природы: α-, β-, y-излучения, токи высокой частоты, ультразвук и др.
Механизм денатурирующего действия высоких температур и интенсивного встряхивания очевиден. Низкие значения рН превращают анионы -СОО- белка в недиссоциированные карбоксильные группы -СООН, а высокие значения рН превращают аммонийные группы -NH3+ в аминогруппы -NH2, поэтому ион-ионные взаимодействия в белковой молекуле нарушаются. Полярные денатурирующие агенты образуют новые для молекулы белка водородные и ионные связи с амидо- и карбонильными группами пептидной цепи и некоторыми группами боковых радикалов (R-групп) аминокислот, подменяя их собственные (нативные) внутримолекулярные связи в белковой молекуле. В результате этих взаимодействий вторичная и третичная структуры белка изменяются.
При денатурации, кроме потерь биологической активности, возникают потери или снижаются растворимость белка и его водопоглотительная способность, происходит изменение вязкости растворов белка, а также механических свойств белоксодержащих продуктов.
Денатурация белков имеет большое значение во многих технологических процессах пищевой промышленности: при выпечке хлеба, сушке макарон, овощей, зерна и семян, отжиме растительного масла на прессах, консервировании, кулинарной обработке пищевых продуктов и ряде других. Под влиянием денатурации белки пищевых продуктов приобретают большую доступность действию протеолитических ферментов, возрастает реакционная способность химических групп, входящих в состав белковой молекулы, изменяется форма белковой молекулы: она «разрыхляется» или становится более компактной в зависимости от условий денатурации, гидрофобность белка растет.
1.3.4. Классификация белков
Несмотря на прогресс в изучении структуры и свойств белков в настоящее время не существует строгой номенклатуры и научной классификации белков. Названия белкам чаще всего дают, принимая во внимание источник выделения белка, или растворимость, форму молекулы, аминокислотный состав и т. д. В зависимости от положенного в основу классификации признака выделяют группы белков. В основе имеющихся классификаций обычно лежит один признак.
Белки классифицируют:
✵ по форме молекул (глобулярные или фибриллярные);
✵ по молекулярной массе (низкомолекулярные, высокомолекулярные и др.);
✵ по химическому строению (простые и сложные по наличию или отсутствию небелковой части);
✵ по выполняемым функциям (транспортные, защитные, структурные белки и др.);
✵ по локализации в клетке (ядерные, цитоплазматические, лизосомальные и др.);
✵ по локализации в организме (белки крови, печени, сердца и др.);
✵ по пищевым источникам;
✵ по сходным участкам первичной структуры и родственным функциям (семейства белков).
Рассмотрим некоторые из перечисленных классификаций. Классификация по форме молекул кратко изложена при обсуждении третичной структуры белков. Классификация по степени сложности подразделяет природные белки на два больших класса - простые и сложные.
Классификация по степени сложности
Природные белки подразделяются на два больших класса - простые и сложные.
Простые белки гидролизуются кислотами или щелочами до аминокислот и не образуют при гидролизе других органических и неорганических соединений. Они состоят только из остатков ос-аминокислот. Следует отметить, что исследования последних лет установили неточность этого утверждения: в ряде случаев белки, которые отнесены к простым, содержат углеводные остатки. Однако обнаруженные изменения не влияют на свойства, приведенные ниже.
Простые белки классифицируют по отношению к некоторым условно выбранным растворителям на несколько групп.
Альбумины - белки, которые растворяются в воде. К этим белкам относятся белок куриного яйца, белки зародыша семян злаковых (однодольных) растений, белки семян двудольных растений. Из водных растворов эти белки хорошо высаливаются, а при кипячении - денатурируют.
Глобулины - белки, растворимые в солях. Обычно для их экстракции применяют 10 %-й раствор NaCl. Многие альбумины и глобулины обладают ферментативными свойствами.
Проламины - белки, которые растворяются в 60-80 %-м растворе этилового спирта. Название «проламины» они получили вследствие того, что в их состав входит большое количество аминокислоты пролина.
Глютелины - белки, которые извлекаются из растительных тканей разбавленными растворами щелочей (0,2 %-й NaOH).
Проламины и глютелины составляют основную массу клейковины пшеницы. Качество клейковины, а, следовательно, и муки зависит от количества и соотношения глиадина и глютенина.
Кроме этих четырех групп, к простым белкам относят протамины и гистоны, обладающие специфическими свойствами.
Протамины - это белки небольшой молекулярной массы, состоящие на 80 % из основных аминокислот и не содержащие серы. Эти белки обнаружены только в сперме (молоках) рыб. По величине молекул протамины - самые малые белки. Основные свойства протаминов объясняются преобладающим присутствием аргинина.
Гистоны - низкомолекулярные белки основного характера, содержатся в хромосомах клеточных ядер и играют важную роль в образовании структуры хроматина. Они локализованы в ядре клетки, рибосомах и митохондриях растений, где играют роль структурных элементов этих органоидов.
Сложные белки (холопротеины), кроме аминокислотных остатков полипептидных цепей белковой части молекулы (апопротеин), содержат также небелковую (простетическую)группу (табл. 3). Связи между полипептидными цепями белка и простетической группой могут быть ковалентными и нековалентными.
Сложный белок может диссоциировать в следующую структуру:
Холопротеин ⇄ Апопротеин + Простетическая группа
Таблица 3. Простетические группы сложных белков
Простетическая группа |
Сложный белок |
|
Групповое название |
Примеры |
|
Атомы (ионы) металлов |
Металлопротеины |
Ферритин, цитохром |
Фосфатные группы |
Фосфопротеины |
Казеин |
Гем |
Хромопротеины |
Миоглобин, гемоглобин |
Моно- или олигосахариды |
Гликопротеины |
Рецепторные белки |
Триацилглицеролы |
Липопротеины |
Липопротеины крови |
ДНК, РНК |
Нуклеопротеины |
Рибосомы, хроматин |
Простетическая группа может быть представлена химическими веществами различной природы. Среди сложных белков липопротеины и нуклеопротеины различаются очень высокой сложностью строения, образуя в живой клетке надмолекулярные структуры, специфическая организация которых обусловлена биохимическими процессами, протекающими с участием этих белков.
Классификация по функциям
Классификация по функциям выделяет следующие группы белков.
Ферменты - белки, обладающие каталитической активностью. Почти все химические реакции, протекающие в клетке, катализируются ферментами.
Транспортные белки специфически связывают и переносят те или другие молекулы и ионы через мембраны клеток. Например, гемоглобин, содержащийся в эритроцитах, при прохождении крови через легкие связывает кислород и доставляет его к периферическим тканям, где кислород высвобождается и используется для окисления компонентов пищи - процесса, в ходе которого производится энергия.
Запасные белки предназначены для потребления зародышами растений и животных на первых стадиях их развития. Примерами таких белков служат белки семян пшеницы, кукурузы и риса, яичный альбумин - основной компонент яичного белка, и казеин, главный белок молока.
Сократительные и двигательные белки обеспечивают клетку или организм способностью сокращаться, изменять форму и передвигаться. Актин и миозин представляют собой фибриллярные белки, функционирующие в сократительной системе скелетной мышцы. Тубулин - важный элемент цитоскелета - ресничек и жгутиков, при помощи которых клетки передвигаются. Длинные клетки нервной системы животных также содержат тубулин.
Структурные белки образуют волокна, выполняющие опорную или защитную функцию, скрепляющие биологические структуры организмов и придающие им прочность. Главным компонентом хрящей и сухожилий является фибриллярный белок коллаген, имеющий очень высокую прочность на разрыв. Связки содержат эластин - структурный белок, способный растягиваться в двух измерениях. Волосы, ногти и перья состоят почти исключительно из прочного нерастворимого белка кератина. Главным компонентом шелковых нитей и паутины служит фибриллярный белок фиброин.
Защитные белки иммунной системы организма защищают от вторжения других организмов или предохраняют от повреждений. Защитными белками являются иммуноглобулины (антитела), образующиеся у позвоночных и обладающие способностью распознавать чужеродные клетки - проникшие в организм бактерии или вирусы, или клетки самого организма, переродившиеся в раковые, а также чужеродные для организма белки, и прочно связываться с ними.
Фибриноген и тромбин - белки, участвующие в процессе свертывания крови; они предохраняют организм от потери крови при повреждении сосудистой системы. Белки змеиного яда, бактериальные токсины и токсичные белки растений, например, рицин, вероятно, также в определенном смысле можно отнести к защитным белкам.
Регуляторные белки участвуют в гормональной регуляции процессов метаболизма в клетке. Например, инсулин регулирует обмен глюкозы; паратериоидный гормон регулирует транспорт ионов кальция и фосфатов и др. Регуляторные белки-репрессоры регулируют биосинтез ферментов в бактериальных клетках.
Имеется много других белков, функции которых уникальны, что затрудняет их классификацию. Так, например, монеллин - белок, содержащийся в одном из африканских растений, имеет очень сладкий вкус. Он стал предметом изучения как заменитель сахара. Плазма крови некоторых антарктических рыб содержит белки со свойствами антифриза, предохраняющие кровь этих рыб от замерзания.
Классификация по пищевым источникам
Пищевая химия делит белки на полноценные (сбалансированные и несбалансированные) и неполноценные по содержанию эссенциальных факторов питания - незаменимых аминокислот. Пищевая химия рассматривает группы белков по пищевым источникам.
Белки семян являются запасными белками, они подвергаются гидролизу при прорастании семян и, таким образом, используются для синтеза новых белков развивающегося проростка. Содержание белков в семенах зерновых и зернобобовых культур колеблется в широких пределах (2,5-50 %). Запасные белки составляют до 80 % от общего количества белков. В вегетативных органах растений, сочных ягодах и плодах содержание белков очень мало из-за высокого содержания воды: в семенах оно составляет от 5 до 15 %, а в корнях, листьях, плодах - от 70 до 95 %. Массовая доля белков в расчете на сухое вещество вегетативных органов растения колеблется от 30 до 40 %.
Белки мяса в биологическом отношении неодинаковы. Содержание белков в мясе 11-21 %. Наиболее ценны белки мышечной ткани - миозин, актин и миоген, включающие все аминокислоты, необходимые человеческому организму для синтеза белков его тканей. Белки соединительных тканей (коллаген и эластин) относятся к неполноценным белкам. Коллагены содержат около 35 % остатков глицина и примерно 11 % остатков аланина. Коллаген содержит также большое количество пролина и оксипролина, на долю которых в сумме приходится 21 %. При частичном гидролизе коллаген превращается в желатин - растворимую и перевариваемую смесь полипептидов.
К белкам молока относятся казеин, альбумин и глобулин. Количество белков в молоке колеблется от 2,8 до 4 %, причем казеин составляет около 82 % общего количества белков, альбумин - 12 % и глобулин - 6 %. Белки молока полноценны. Казеин принадлежит к фосфопротеинам и отличается от других белков молока тем, что содержит в своей молекуле фосфор. В молоке казеин находится в соединении с кальциевыми солями, образуя казеин-фосфат-кальциевый комплекс. Альбумин относится к полноценным белкам. В молоке альбумина мало: 0,4-0,6 %. Глобулин содержится в молоке в небольшом количестве (до 0,2 %). Он имеет очень важное значение для новорожденных, так как обладает сильными бактерицидными свойствами и повышает резистентиость организма.
Классификация по сходным участкам первичной структуры и родственным функциям
Семейства родственных белков образовались, по-видимому, в ходе эволюции в пределах одного биологического вида. Частичные изменения первичной структуры при сохранении в молекулах белков гомологичных последовательностей аминокислот могут приводить к возникновению разных белков, выполняющих родственные функции. Гомологичными называют последовательности, имеющие много сходных черт. Они содержат во многих положениях одни и те же аминокислоты, называемые инвариантными, а в некоторых положениях могут находиться разные, но близкие по физико-химическим свойствам аминокислотные остатки.
Эти белки имеют поразительно схожие конформации: количество и взаиморасположение α-спиралей и/или β-структур, большинство поворотов и изгибов полипептидных цепей сходно или идентично. Такие белки, имеющие гомологичные участки полипептидной цепи, сходную конформацию и родственные функции, выделяют в семейства белков.
Пример семейства родственных белков - семейство миоглобина, куда включены, кроме самого миоглобина, и все виды гемоглобина. К семейству родственных белков относят сериновые протеазы. Это семейство ферментов, которые используют уникально активированный остаток серина, расположенный в активном центре, для связывания и каталитического гидролиза пептидных связей в белковых субстратах.
1.3.5. Свойства белков
Молекулярная масса большинства белков составляет от нескольких десятков до сотен килодальтон (кD). В водной среде белки образуют растворы, обладающие свойствами и коллоидных и истинных растворов. Как компоненты коллоидных растворов белки не проходят через полупроницаемые мембраны (на этом основан метод очистки белков от низкомолекулярных примесей, который называется диализом) и рассеивают свет (эффект Тиндаля). Растворы белков обладают также свойствами истинных растворов, так как образуются и существуют без внесения дополнительной энергии.
Растворимость большинства белков в воде обусловлена наличием на их поверхности гидрофильных групп (гидроксильных, сульфгидрильных, амидных), принадлежащих к полярным аминокислотам (серин, цистеин, аспарагин, глутамин и др.) и способных связывать воду. Неполярные аминокислоты, обладающие гидрофобными боковыми радикалами (аланин, валин, лейцин, фенилаланин и др.), снижают растворимость белка в воде.
Молекулы белка - заряженные частицы. Суммарный заряд белка определяется соотношением отрицательно и положительно заряженных аминокислот на поверхности белковых молекул, а также величиной рН раствора. Лизин, аргинин и гистидин в нейтральной и кислой среде заряжаются положительно благодаря наличию в их боковых радикалах, соответственно, аминогруппы, гуанидиновой группы и имидазольного кольца (рис. 16, а). Отрицательный заряд могут приобретать в нейтральной и щелочной среде глутаминовая и аспарагиновая кислоты, в боковых радикалах которых содержатся свободные карбоксильные группы (рис. 16, б). Значение рН, при котором суммарный заряд белка является минимально возможным (нулевым), называется изоэлектрической точкой (ИЭТ, pI) (рис. 16, в).
Рис. 16. Заряд белковой молекулы при различных значениях рН: а - рН <рI; б - рН> рI; в - рН = рI
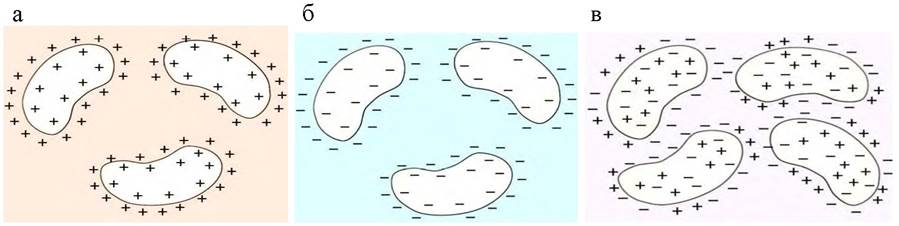
В зависимости от аминокислотного состава белки подразделяются на нейтральные (рI 5,0 -7,0), кислые (рI <4,0) и основные (рI >7,5).
Способность белков проявлять как кислые, так и основные свойства позволяет отнести их к амфотерным электролитам (амфолитам).
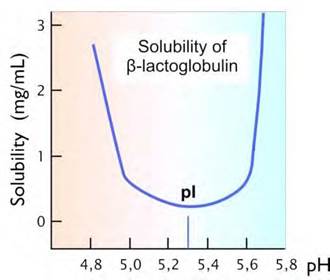
В изоэлектрической точке молекула белка электронейтральна, вследствие чего водный раствор белка при рН, равном рI наименее устойчив и белок легче выпадает в осадок (рис. 17). Это явление применяется для определения изоэлектрической точки белка.
Рис. 17. График зависимости растворимости белка в воде от значения рН раствора
Как заряженные частицы молекулы белка притягивают к себе диполи воды, которые располагаются вокруг белковой молекулы и образуют водную или гидратную оболочку (рис. 18).
Рис. 18. Образование гидратной оболочки вокруг молекулы белка
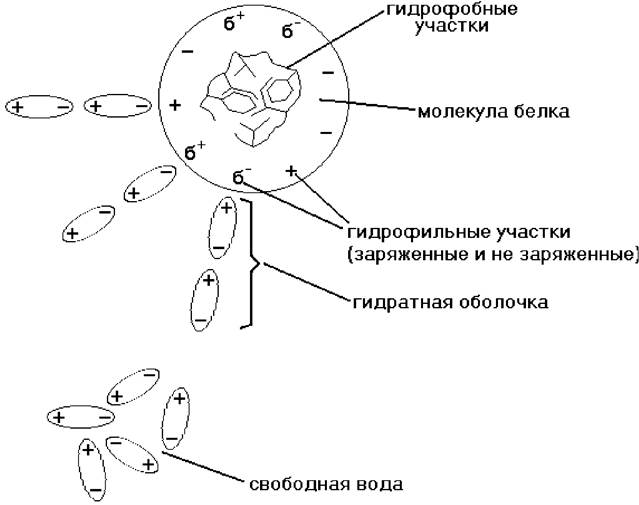
Величина гидратной оболочки зависит от структуры белка. Например, альбумины более легко связываются с молекулами воды и имеют относительно большую водную оболочку, тогда как глобулины, фибриноген присоединяют воду хуже и гидратная оболочка у них меньше. Таким образом, устойчивость водного раствора белка определяется двумя факторами: наличием заряда белковой молекулы и находящейся вокруг нее водной (гидратной) оболочки. При удалении этих факторов белок выпадает в осадок. Данный процесс может быть обратимым и необратимым.
Так как белки являются полиамфолитами, на основе белков в организме действуют белковые буферные системы.
Обратимое осаждение белков (высаливание) предполагает выпадение белка в осадок под действием определенных веществ, после удаления которых он вновь возвращается в свое исходное (нативное) состояние. Для высаливания белков используют соли щелочных и щелочноземельных металлов (наиболее часто в практике используют сульфат натрия и аммония). Эти соли удаляют водную оболочку (вызывают обезвоживание) и снимают заряд. Между величиной водной оболочки белковых молекул и концентрацией солей существует прямая зависимость: чем меньше гидратная оболочка, тем меньше требуется солей. Так, глобулины, имеющие крупные и тяжелые молекулы и небольшую водную оболочку, выпадают в осадок при неполном насыщении раствора солями, а альбумины как более мелкие молекулы, окруженные большой водной оболочкой, - при полном насыщении.
Необратимое осаждение связано с глубокими внутримолекулярными изменениями структуры белка, что приводит в потере молекулой белка нативных свойств (растворимости, биологической активности и др.). Денатурация белков происходит в желудке, где имеется сильнокислая среда (рН 0,5-1,5), что способствует расщеплению белков протеолитическими ферментами. Денатурация белков положена в основу лечения отравления тяжелыми металлами, когда больному вводят per os (через рот) молоко или сырые яйца с тем, чтобы металлы, денатурируя белки молока или яиц, адсорбировались на их поверхности и не действовали на белки слизистой оболочки желудка и кишечника, а также не всасывались в кровь.
Благодаря наличию заряда белки подвижны в электрическом поле. Метод исследования белков, основанный на различной скорости движения белковых частиц, различающихся величиной заряда при определенном значении рН, называется электрофорезом.
Белки обладают комплексообразующими свойствами. Являясь активными полидентатными лигандами, белки образуют комплексные соединения разной устойчивости и выполняют роль ионофоров в организме для многих катионов (Na+, К+). С Мg+2 и Са+2 образуют достаточно прочные, а с катионами d-металлов (Fe, Mg, Cu, Mo, Co - «металлы жизни») - прочные комплексы. Особенно прочные комплексы белки образуют с катионами металлов-токсикантов: Pb, Cd, Hg.
Многие ферменты являются комплексами белка с «металлами жизни», при этом именно катион комплексообразователя является активным центром фермента, а фрагмент белковой молекулы выполняет функцию узнавания и активации субстрата.
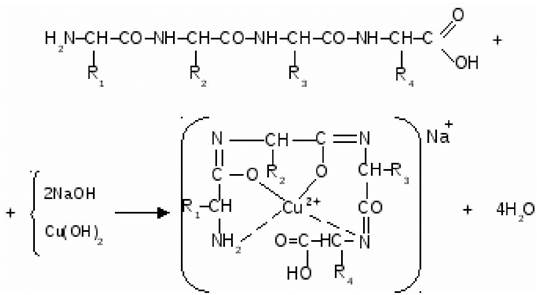
Все белки при обработке солями меди в щелочной среде образуют хелатный комплекс фиолетового цвета. Это качественная реакция на белки, которая носит название биуретовая реакция (рис. 19).
Рис. 19. Образование комплексного соединения белка с катионом меди Cu2+
1.3.6. Биологическая ценность белков
Белок - наиболее важный компонент пищи человека. Жизнедеятельность человека обеспечивается ежедневным потреблением с пищей сбалансированной смеси, содержащей восемь незаменимых аминокислот и две частично заменимые. Нехватка одной незаменимой кислоты приводит к неполному усвоению других.
Биологическая ценность белка по аминокислотному составу может быть оценена при сравнении его с аминокислотным составом эталонного белка. Наиболее широко используется метод Х. Митчела и Р. Блока, в соответствии с которым рассчитывается показатель аминокислотного скора (а. с.). Скор выражают в процентах или безразмерной величиной, представляющей собой отношение содержания незаменимой аминокислоты в исследуемом белке к ее количеству в эталонном белке. Аминокислота, скор которой имеет самое низкое значение, называется первой лимитирующей аминокислотой. Значение скора этой аминокислоты определяет биологическую ценность белка.
Для взрослого человека в качестве эталонного белка применяют аминокислотную шкалу Комитета ФАО/ВОЗ (табл. 4).
Таблица 4. Рекомендуемый аминокислотный состав эталонного белка (шкала Комитета ФАО/ВОЗ)
Незаменимая аминокислота |
Содержание в 1 г идеального белка (мг) |
Лейцин |
70 |
Изолейцин |
40 |
Лизин |
55 |
Валин |
50 |
Треонин |
40 |
Триптофан |
10 |
Метионин + цистеин |
35 |
Фенилаланин + тирозин |
60 |
Животные белки являются полноценными, их аминокислотный состав близок к таковому у человека. Большинство растительных белков содержат недостаточное количество одной или нескольких незаменимых аминокислот. Так, например, белки злаковых культур неполноценны по лизину, метионину, треонину. В белке ряда бобовых не хватает метионина и цистина.
Наряду с аминокислотным составом биологическая ценность белков определяется и степенью их усвоения. Животные и растительные белки усваиваются организмом неодинаково. Если белки молока, молочных продуктов, яиц усваиваются на 96 %, мяса и рыбы - на 93-95 %, то белки хлеба - на 62-86 %, овощей - на 80 %, картофеля и некоторых бобовых - на 70 %. На степень усвоения организмом белков оказывает влияние технология получения пищевых продуктов и их кулинарная обработка.
Суточная потребность взрослого человека в белке разного вида около 1-1,5 г на 1 кг массы тела, т. е. примерно 75-100 г. Доля животных белков должна составлять приблизительно 55 % от общего количества.
Вопросы и задания для самопроверки
1. Опишите строение протеиногенных аминокислот.
2. Приведите уравнения реакций, подтверждающих амфотерные свойства природных аминокислот.
3. Приведите классификации природных аминокислот по строению бокового радикала.
4. Что означает изоэлектрическая точка аминокислоты?
5. Перечислите и напишите формулы заменимых аминокислот.
6. Перечислите и напишите формулы незаменимых аминокислот.
7. В чем состоит биологическая ценность белков?
8. Опишите следующие физико-химические свойства белков: молекулярная масса, растворимость, термолабильность,
9. В чем причина амфотерности белковых молекул?
10. Какие методы осаждения белков из растворов Вам известны?
11. От чего зависит заряд белковых молекул?
12. Что определяет значение изоэлектрической точки белков?
13. Напишите схему пептидной связи и укажите ее свойства.
14. Дайте определение первичной структуры белков. Опишите ее биологическое значение.
15. Дайте определение вторичной структуры белков. Какие элементы вторичной структуры Вам известны?
16. Изобразите химические связи, стабилизирующие вторичную структуру.
17. Нарисуйте схемы α- и β-структур белковой молекулы.
18. Дайте определение третичной структуры белков. Опишите ее биологическое значение.
19. Изобразите химические связи, участвующие в формировании третичной структуры.
20. Дайте определение четвертичной структуры белков. Опишите ее биологическое значение.
21. Приведите примеры белков, имеющих четвертичную структуру.
22. В чем состоит явление денатурации белков? Что такое «обратимая» и «необратимая» денатурация?
23. Какие разновидности денатурации имеют практическую ценность?
24. Перечислите условия, вызывающие «обратимую» и «необратимую» денатурацию белков.
25. Какие критерии лежат в основе классификации белков?
26. Приведите характеристику простых белков и их основные группы.
27. Приведите характеристику сложных белков и их основные группы.
28. Опишите условия устойчивости водного раствора белка.
29. Опишите практическое значение обратимого осаждения белков.
30. Приведите примеры проявления комплексообразующих свойств белков.
Задания для самостоятельной работы
Задание 1
1. Определите свойства боковых радикалов R двадцати протеиногенных аминокислот на основании знаний о строении и свойствах органических соединений.
2. Запомните наименования и соответствующие трехбуквенные и однобуквенные обозначения протеиногенных аминокислот.
3. Заполните табл. 5:
Таблица 5. Свойства и номенклатура аминокислот
Свойства бокового радикала R |
Перечень и номенклатура аминокислот |
|
Названия |
Обозначения |
|
Неполярные (гидрофобные) |
||
Полярные (гидрофильные) |
||
Образующие Н-связь |
||
Серосодержащие |
||
Заряженные отрицательно (при рН 7) |
||
Заряженные положительно (при рН 7) |
||
Ароматические |
||
Алифатические |
||
Образующие ковалентную дисульфидную связь -S-S- |
||
Гетероциклические |
||
Циклическая аминокислота |
||
Задание 2
1. Напишите структурную и сокращенную формулу пептида в соответствии с предложенной в табл. 6 аминокислотной последовательностью.
2. Укажите C- и N-концевые аминокислоты в заданной аминокислотной последовательности.
Дайте характеристику каждой аминокислоте, входящей в состав пептида, в соответствии с классификацией протеиногенных α-аминокислот: а) по строению бокового радикала; б) по отношению к воде. Укажите незаменимые аминокислоты.
Таблица 6. Варианты заданий для самостоятельной работы
№ |
Аминокислотная последовательность |
1 |
Пролил-валил-аспарагил-тирозил-триптофил-изолейцин |
2 |
Гистидил-аспарагинил- изолейцил-серил-метионил-аргинин |
3 |
Изолейцил-аланил-серил-метионил-аргинил-аспарагин |
4 |
Глутаминил-лейцил-гистидил-пролил-валил-аспарагин |
5 |
Валил-аспарагинил-триптофил-изолейцил-аланил-серин |
6 |
Серил-аргинил-глутаминил-лейцил-лизил-валин |
7 |
Триптофил-аланил-метионил-цистеин-аспарагил-глицин |
8 |
Гистидил-пролил-глутамил-аргинил-аспарагинил-гистидин |
9 |
Лейцил-гистидил-пролил-аспарагил-тирозил-триптофан |
10 |
Метионил-аргинил-аспарагил-лизил-валил-аспарагинин |