ОСНОВЫ БИОХИМИИ И МОЛЕКУЛЯРНОЙ БИОЛОГИИ - Н. Н. Скворцова - 2016
Часть I. Химические компоненты клетки
2. ФЕРМЕНТЫ
2.1. Химическая природа и строение ферментов
Ферменты - вещества, которые присутствуют в тканях и клетках всех живых организмов и способны во много раз ускорять протекающие в них химические реакции.
В отличие от большинства катализаторов неорганической природы ферменты обладают более высокой эффективностью и специфичностью действия. В то время как небелковые катализаторы обычно ускоряют реакции в 10-103 раз, степень ускорения реакций под действием ферментов составляет 106-1012.
В основном, ферменты - это специфические белки. Однако в 80-х годах ХХ века Т. Чек и С. Альтман обнаружили каталитические свойства рибонуклеиновых кислот (РНК), а в 1989 году их открытие было удостоено Нобелевской премии по химии. В данном разделе обсуждение будет посвящено самой крупной группе ферментов - высокоспециализированным белковым молекулам.
Ферменты, как и все белки, обладают рядом характерных свойств: амфотерностью, электрофоретической подвижностью и неспособностью к диализу через полупроницаемые мембраны. Ферменты имеют большую молекулярную массу - от десятков тысяч до нескольких миллионов дальтон. Им присущи все особенности структурной организации белковых молекул (первичный, вторичный, третичный и четвертичный уровни организации).
Ферменты могут быть простыми белками, целиком построенными из полипептидных цепей и распадающимися при гидролизе только на аминокислоты. Простыми белками являются гидролитические ферменты (например, протеазы, липазы, рибонуклеаза), выполняющие свою функцию в отсутствие кофермента. В большинстве случаев ферменты - сложные белки (рис. 20). Сложные белки (холоферменты) содержат наряду с белковой частью (апоферментом) небелковый компонент (кофермент или простетическую группу).
Рис. 20. Схема строения ферментов
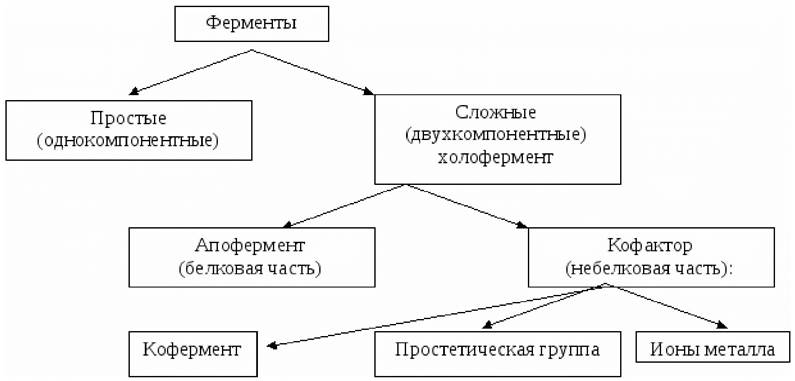
Апофермент обеспечивает специфичность действия фермента. Кофермент чаще всего связан с белковой частью молекулы нековалентными взаимодействиями - водородными, гидрофобными или ионными связями. При этом кофермент взаимодействует с ферментом только на время химической реакции. Реже встречается ковалентное связывание апофермента с простетической группой. Коферменты и простетические группы принимают непосредственное участие в процессе катализа.
Большая группа коферментов представляет собой водорастворимые витамины и их производные (табл. 7).
Таблица 7. Некоторые коферменты и простетические группы ферментов
Наименование |
Витамин |
Переносимые группы |
Никотинамидаденин-динуклеотид (НАД, НАДФ) |
Никотинамид (РР) |
Атомы водорода (электроны) |
Флавинмононуклеотид, рибофлавинфосфат (ФМН, ФАД) |
Рибофлавин (В2) |
Атомы водорода (электроны) |
Коэнзим А (СоА) |
Пантотеновая кислота (В5) |
Ацильные, ацетильные |
Тетрагидрофолиевая кислота (ТГФ) |
Фолиевая кислота (В9) |
Метильные, формильные |
Тиаминдифосфат (ТДФ) |
Тиамин (В1) |
Альдегиды и кетоны |
Пиридоксаль-5-фосфат |
Пиридоксин (В6) |
Амино- и карбоксильные |
Следует отметить одну отличительную особенность двухкомпонентных ферментов: только объединение апофермента с кофактором обладает каталитической активностью. Более 25 % всех ферментов для проявления полной каталитической активности нуждается в ионах металлов.
Вещество, химическое превращение которого катализирует фермент, носит название субстрат. Фермент, соединяясь с субстратом, образует фермент-субстратный комплекс(рис. 21):
Рис. 21. Образование фермент-субстратного комплекса в ходе катализируемой реакции
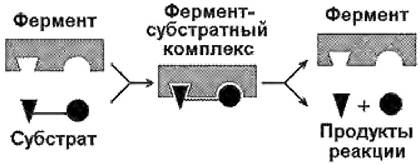
Молекулы субстратов, участвующие в ферментативных реакциях, часто имеют небольшие размеры по сравнению с молекулами ферментов, поэтому было высказано предположение, что при образовании фермент-субстратных комплексов в непосредственный контакт с молекулой субстрата вступает ограниченная часть аминокислотных остатков пептидной цепи. Таким образом, возникло представление об активном центре фермента.
Активный центр - это уникальная комбинация аминокислотных остатков в молекуле фермента, обеспечивающая непосредственное связывание с молекулой субстрата и прямое участие в акте катализа (рис. 22). К каталитически активным аминокислотным радикалам белка относятся нуклеофильные группы (имидазол гистидина, оксигруппа серина или тирозина, тиольная группа цистеина, β-аминогруппа лизина, ионизированные карбоксилы аспарагиновой и глутаминовой кислот и др.) и электрофильные группы (ион имидазолия гистидина, неионизованные карбоксильные группы аспарагиновой и глутаминовой кислот).
В первичной структуре молекулы фермента группы активного центра обычно удалены друг от друга (рис. 22, б). Однако в третичной структуре аминокислотные остатки, принимающие участие в катализе, ориентированы в сближенном состоянии, удобном для их взаимодействия с молекулой субстрата (рис. 22, а). Субстратная специфичность объясняется пространственным соответствием активного центра фермента и его субстрата.
Рис. 22. Строение активного центра фермента: а - присоединение субстрата к ферменту в активном центре; б - положение в первичной структуре белка аминокислотных остатков, формирующих активный центр фермента; в - активный центр фермента условно разделяется на участок связывания и каталитический участок
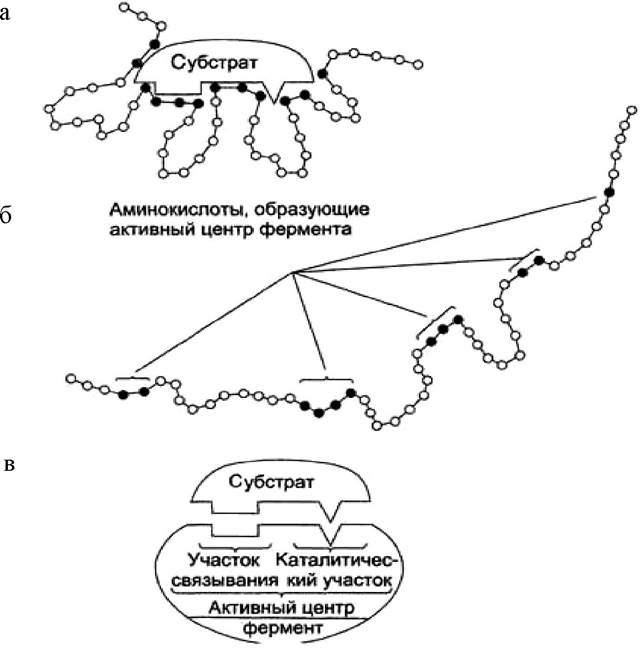
В активном центре фермента участок связывания обеспечивает формирование комплекса фермента с субстратом. Каталитический участок обеспечивает химическое превращение субстрата. Каждый фермент имеет один или несколько активных центров, с которыми связывается субстрат. Эти центры высокоспецифичны, т. е. «узнают» только «свой» субстрат или близкородственные соединения. В молекуле фермента может присутствовать также аллостерический центр (или центры) (от греч. allos - другой, иной и steros - пространственный, структурный). Это участок молекулы фермента, с которым связываются определенные, обычно низкомолекулярные, вещества-эффекторы - активаторы или ингибиторы (рис. 23).
Рис. 23. Схема действия аллостерического центра фермента под влиянием эффекторов: а - активация активного центра; б - ингибирование активного центра
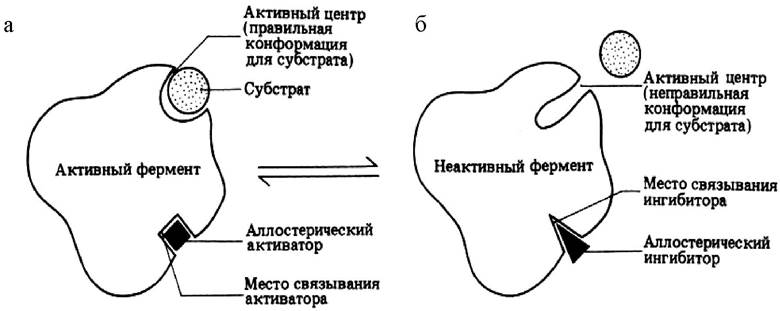
Присоединение эффектора к аллостерическому центру изменяет пространственную структуру молекулы фермента и, соответственно, конфигурацию активного центра, вызывая снижение или повышение ферментативной активности. Ферменты, активность каталитического центра которых подвергается изменению под влиянием аллостерических эффекторов, связывающихся с аллостерическим центром, называются аллостерическими ферментами.
Многие ферменты характеризуются наличием разных форм, которые существуют в одном организме, но, как правило, в разных его клетках, тканях или органах. Эти формы называются изоферментами. Изоферменты выполняют одну и ту же каталитическую функцию, но могут значительно различаться по степени каталитической активности, по особенностям регуляции или другим свойствам. Изоферменты могут незначительно различаться по аминокислотной последовательности и пространственной конфигурации, по субъединичному составу и свойствам.
Примером фермента, имеющего изоферменты, является амилаза. Панкреатическая амилаза отличается по аминокислотной последовательности и свойствам от амилазы слюнных желёз, кишечника и других органов.
2.2. Механизм действия ферментов
Необходимой стадией ферментативного катализа является соединение фермента E с субстратом S, в результате чего образуется фермент-субстратный комплекс ES:
E + S ⇄ ES —> P + S
Процесс ферментативного катализа можно разделить на три стадии:
1) диффузия субстрата к ферменту и образование ферментсубстратного комплекса (ES);
2) преобразование первичного комплекса в один или несколько активированных фермент-субстратных комплексов;
3) отделение продуктов реакции (Р) от активного центра и диффузия его в окружающую среду.
Первая стадия обычно непродолжительна и зависит от концентрации субстрата в среде, а также его диффузии к активному центру фермента. Комплекс образуется практически мгновенно.
Вторая стадия наиболее медленная и лимитирует скорость всего катализа в целом. Ее длительность зависит от энергии активации данной химической реакции. Образование фермент-субстратного комплекса способствует снижению энергии активации Еа для достижения молекулой субстрата переходного (активированного) состояния и осуществления реакции (рис. 24).
Рис. 24. Влияние фермента на энергию активации реакции
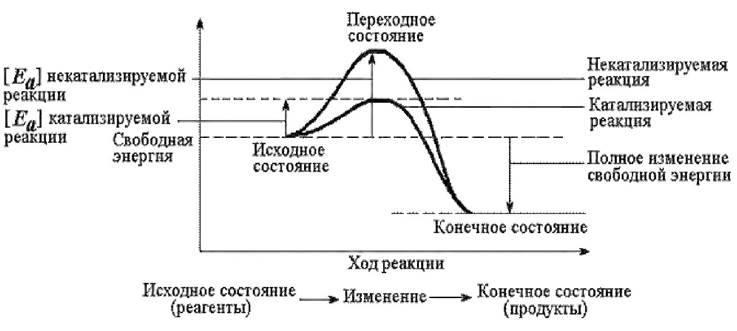
По завершении реакции (конечное состояние) фермент- субстратный комплекс распадается на продукт (продукты) реакции и фермент. Третья стадия практически мгновенна. Она определяется скоростью диффузии продуктов реакции в окружающую среду. Фермент по окончании реакции возвращается в свое исходное состояние и может взаимодействовать с новой молекулой субстрата.
Ферменты не могут влиять на положение равновесия ускоряемых реакций; при этом в ходе реакций они не расходуются и не претерпевают необратимых изменений. Ферменты с термодинамической точки зрения ускоряют химические реакции за счет снижения энергии активации путем увеличения числа активированных молекул, которые на более низком энергетическом уровне становятся реакционноспособными.
2.3. Основы кинетики ферментативных реакций
Ферментативная кинетика изучает скорости реакций, катализируемые конкретными ферментами, а также закономерности влияния природы реагирующих веществ на скорости ферментативных реакций. Отличительная особенность ферментативных реакций - явление насыщения активного центра фермента субстратом.
Скорость ферментативной реакции зависит от концентрации субстрата [S] и количества присутствующего фермента [Е]. В большинстве биохимических реакций концентрация фермента очень мала, а субстрат присутствует в избытке. При проведении ферментативной реакции в условиях избытка субстрата скорость реакции будет пропорциональна концентрации фермента. Графическая зависимость такой реакции имеет вид прямой линии (рис. 25).
Рис. 25. Зависимость скорости ферментативной реакции (v) от концентрации фермента

Количество фермента часто невозможно определить в абсолютных величинах, поэтому на практике пользуются условными величинами, характеризующими активность фермента.
Стандартная единица фермента - это такое количество фермента, которое катализирует превращение одного микромоля (мкМ) данного субстрата за одну минуту при заданных условиях. Стандартная единица фермента обозначается буквой Е (единица) или буквой U (unit).
Катал - каталитическая активность, при которой ферментативная реакция осуществляется со скоростью, равной одному молю в секунду в заданной системе измерения активности. Каталитическая активность в 1 катал (кат) при практическом применении оказывается слишком большой величиной, поэтому в большинстве случаев каталитические активности выражают в микро-каталах (мккат), нано- каталах (нкат) или пико-каталах (пкат).
Стандартная единица фермента и катал находятся в следующих соотношениях:
1 кат = 1 моль S/сек = 60 моль S/мин = 60х106 мкмоль/мин = 6 х 107 E (U);
1Е (U) = 1 мкмоль/мин = 1/60 мкмоль/с = 1/60 мккат = 16,67 нкат.
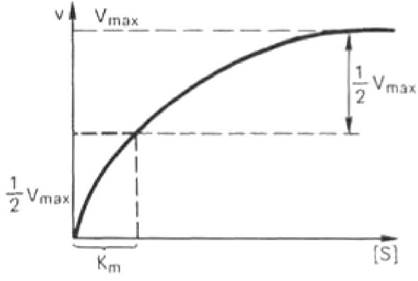
Концентрация субстрата [S] определяет, сколько молекул фермента соединится с субстратом при образовании ферментсубстратного комплекса [ES]. При малых [S] скорость реакции возрастает пропорционально концентрации субстрата (рис. 26). Однако при достаточно большом увеличении скорость реакции перестает зависеть от [S] - наступает насыщение, когда все молекулы фермента оказываются занятыми субстратом.
Рис. 26. Зависимость скорости ферментативной реакции от концентрации субстрата
Биохимики исследуют процессы, достигшие стационарного состояния, при котором образование фермент-субстратного комплекса со скоростью k1 уравновешивается его превращением в продукт со скоростью k2:
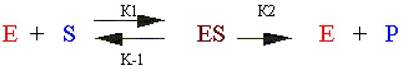
Наряду с образованием фермент-субстратного комплекса возможна его диссоциация со скоростью k-1 на фермент и исходный субстрат. В этих условиях зависимость скорости ферментативного превращения субстрата (v) от его концентрации [S] описывается уравнением Михаэлиса - Ментен:
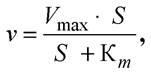
где Кm - константа Михаэлиса, характеризующая активность фермента, Vmax - максимальная скорость реакции при данной суммарной концентрации фермента. На графике (см. рис. 18) показано, что Кm равна концентрации субстрата [S], при которой скорость ферментативной реакции у составляет половину от Vmax. Km имеет размерность моль/л.
Константа Михаэлиса является важным параметром при исследовании ферментов, характеризующим степень сродства фермента к субстрату. Константа Михаэлиса численно равна отношению суммы констант скоростей реакций, в которых фермент-субстратный комплекс распадается, к константе скорости реакции, в которой он образуется:
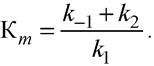
Определение величины Кm имеет важное значение при выяснении механизма действия эффекторов на активность ферментов.
Для более удобного графического представления экспериментальных данных Г. Лайнуивер и Д. Бэрк преобразовали уравнение по методу двойных обратных величин исходя из того принципа, что если существует равенство между двумя какими-либо величинами, то и обратные величины также будут равны. Выражение, обратное уравнению Ми- хаэлиса - Ментен, представляет собой уравнение Лайнуивера-Бэрка:
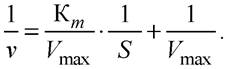
Это уравнение прямой линии: у = ах + b. Благодаря этому уравнению можно определять в одном эксперименте константу Михаэлиса Кm и максимальную скорость Vmaxисследуемой ферментативной реакции.
В графическом варианте метод Лайнуивера-Бэрка называют еще методом двойных обратных величин (рис. 27):
Рис. 27. График Лайнуивера-Бэрка
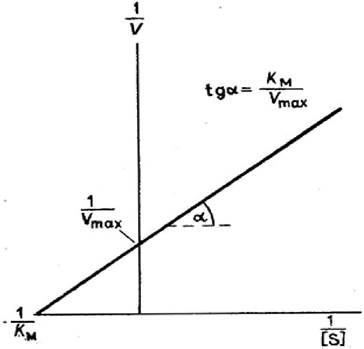
При построении графика на оси абсцисс откладывают величину, равную 1/[S], а на оси ординат - 1/V. Тангенс угла наклона прямой будет равен величине Km/Vmax; отрезок, отсекаемый прямой от оси ординат, представляет собой l/Vmax (обратная величина максимальной скорости). Если продолжить прямую линию за ось ординат, то на абсцисс отсекается отрезок, соответствующий обратной величине константы Михаэлиса - 1/Кm.
Таким образом, величину Кm можно вычислить из данных наклона прямой и длины отрезка, отсекаемого от оси ординат, или из длины отрезка, отсекаемого от оси абсцисс в области отрицательных значений. Следует подчеркнуть, что по методу двойных обратных величин значения Vmax, как и величину Кm, можно определить более точно, чем по графику, построенному в прямых координатах (см. рис. 26). Поэтому данный метод нашел широкое применение в исследованиях ферментов.
2.4. Основные свойства ферментов
2.4.1. Отличие от неорганических катализаторов
От неорганических катализаторов ферменты отличаются рядом характерных особенностей, которые перечислены ниже.
Ферменты чрезвычайно эффективны и проявляют более высокую (в 108-1020 раз) каталитическую активность: 1 молекула фермента может превратить от 1000 до 1 млн молекул субстрата за одну минуту. Эта скорость недостижима для небиологических катализаторов.
Ферменты проявляют каталитическую активность в условиях умеренной температуры (температура тела), нормального давления и в области близких к нейтральным значениям рН среды.
Ферменты отличаются высокой специфичностью действия в отношении как химической природы субстрата, так и типа реакции, т. е. каждый фермент катализирует в основном только определенную химическую реакцию.
Ферменты термолабильны и неустойчивы по отношению к кислотам и щелочам.
Активность ферментов в клетках строго контролируется: воздействуя на фермент, можно регулировать скорость соответствующей реакции.
Ферменты в отличие от неорганических катализаторов не вызывают каких-либо побочных реакций.
Скорость ферментативной реакции прямо пропорциональна количеству фермента.
2.4.2. Специфичность действия ферментов
По субстратной специфичности - способности избирательно ускорять определенную реакцию - различают ферменты, обладающие абсолютной специфичностью (т. е. действующие только на одно конкретное вещество и катализирующие только определенное превращение этого вещества), и ферменты, обладающие относительной, или групповой, специфичностью (т. е. катализирующие превращения молекул, обладающих определенным сходством) и стереоспецифичностью.
Так, ферментом с абсолютной специфичностью является уреаза, катализирующая гидролиз мочевины:
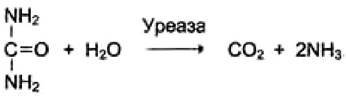
Относительная субстратная специфичность характерна для многих ферментов, катализирующих превращение группы субстратов сходной химической структуры. Например, алкогольдегидрогеназа катализирует превращение этанола и других алифатических спиртов, но с разной скоростью.
Примером стереохимической субстратной специфичности является фумаратгидратаза, которая катализирует превращение только одного стереоизомера субстрата:
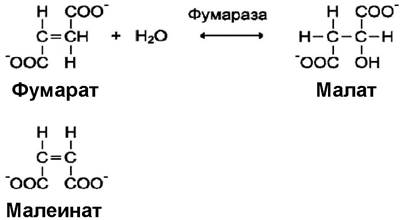
Фермент катализирует присоединение молекулы воды к кратной связи транс-аниона фумаровой кислоты, но не к ее стереоизомеру - цис-аниону малеиновой кислоты. Фермент лактатдегидрогеназа катализирует превращение только L-формы молочной кислоты, но полностью инертен к ее D-форме.
2.4.3. Термолабильность ферментов
Чувствительность к изменению температуры является одним из характерных свойств ферментов.
Оптимальной температурой для действия большинства ферментов является 37-45 °С (рис. 28). При низких температурах (0° или ниже) ферменты, как правило, не денатурируются, хотя активность их падает почти до нуля.
Рис. 28. Зависимость скорости ферментативной реакции от температуры
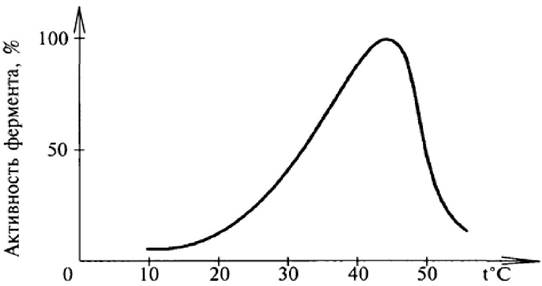
На восходящем участке кривой скорость ферментативной реакции по закону действующих масс пропорциональна температуре, нисходящая ветвь кривой обусловлена, в основном, денатурацией фермента и, как следствие, дезинтеграцией его активного центра.
2.4.4. Влияние рН среды на активность ферментов
Ферменты крайне чувствительны к изменению концентрации водородных ионов. При этом меняется степень ионизации функциональных групп в боковых радикалах аминокислотных остатков, особенно в активном центре фермента, что приводит к изменению конформации белковой макромолекулы. Изменение рН влияет также на степень связывания фермента с субстратом. Как и температурная зависимость, рН-зависимость скорости ферментативной реакции имеет колоколообразную форму (рис. 29).
Рис. 29. Зависимость скорости ферментативной реакции от рН среды
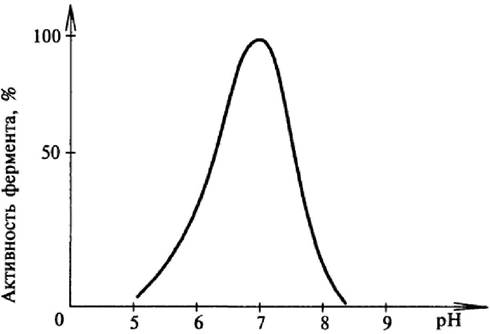
Функциональные группы активного центра фермента наиболее эффективно взаимодействуют с субстратом, имея оптимальную степень ионизации, обусловленную соответствующим значением рН. Это соответствует максимальной скорости реакции, отклонение от этих значений приводит к снижению скоростей реакций, а при крайних значениях рН - и к денатурации белка-фермента.
Влияние рН на образование фермент-субстратного комплекса, кроме ионизации функциональных группировок фермента, может оказывать существенное воздействие на определенные группы субстрата, что также влияет на скорость реакции.
При графическом изображении на кривой колоколообразной формы имеется определенная точка, при которой фермент проявляет максимальную активность; эту точку называют оптимумом pH среды для действия данного фермента. В табл. 8 приведены оптимальные значения pH среды для ряда ферментов.
Таблица 8. Оптимумы pH среды для действия некоторых ферментов
Ферменты |
рН |
Пепсин |
1,5-2,5 |
Амилаза слюны |
6,8-7,0 |
Амилаза из солода |
4,9-5,2 |
Уреаза |
7,0-7,2 |
Липаза панкреатическая |
7,0-8,5 |
Трипсин |
7,5-8,5 |
Аргиназа |
9,5-10,0 |
2.4.5. Влияние активаторов и ингибиторов на активность ферментов
Температура и рН относятся к неспецифическим факторам, так как в той или иной мере влияют на активность всех ферментов. Кроме того, существуют вещества, которые в очень низких концентрациях повышают активность ферментов (активаторы) или, напротив, снижают ее (ингибиторы).
К числу веществ, повышающих активность ферментов, относятся катионы металлов и некоторые анионы. Чаще всего активаторами ферментов являются катионы Mg2+, Mn2+, Zn2+, K+ и Со2+, а из анионов - Сl. Катионы действуют на ферменты по-разному: в одних случаях они облегчают образование фермент-субстратного комплекса, в других способствуют присоединению кофермента к апоферменту, либо присоединяются к аллостерическому центру фермента и изменяют его третичную структуру, в результате чего субстратный и каталитический центры приобретают наиболее выгодную для осуществления катализа конфигурацию.
Следует различать металлы-кофакторы и металлы-активаторы ферментов. Кофакторы могут прочно связываться с белковой частью фермента, что же касается активаторов, то они легко отделяются от апофермента. Кофакторы входят в состав фермента и являются обязательными участниками каталитического акта; в их отсутствие фермент неактивен. Активаторы усиливают каталитическое действие, но их отсутствие не препятствует протеканию ферментативной реакции.
Ингибиторы тормозят действие ферментов. Ингибиторами могут быть как эндогенные, так и экзогенные вещества. Различают обратимое и необратимое ингибирование. Если ингибитор вызывает стойкие изменения пространственной третичной структуры молекулы фермента или модификацию функциональных групп фермента, то такой тип ингибирования называется необратимым. Чаще, однако, имеет место обратимое ингибирование, поддающееся количественному исследованию на основе уравнения Михаэлиса-Ментен.
Обратимое ингибирование разделяют на конкурентное и неконкурентное в зависимости от того, удается или не удается преодолеть торможение ферментативной реакции путем увеличения концентрации субстрата. При взаимодействии фермента с конкурентным ингибитором изменяется значение константы Михаэлиса (Кm) ферментативной реакции. При конкурентном ингибировании ингибитор (I) связывается с активным центром фермента и конкурирует за него с субстратом. Конкурентный ингибитор обычно структурно похож на субстрат, однако фермент неспособен катализировать реакцию в присутствии ингибитора из-за отсутствия у последнего необходимых функциональных групп. Схема конкурентного ингибирования выглядят следующим образом:
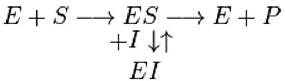
Неконкурентный ингибитор не имеет структурного сходства с субстратом и поэтому не мешает связыванию субстрата с ферментом. Он способен присоединяться как к свободному ферменту, так и к фермент-субстратному комплексу с одинаковой эффективностью. Ингибитор вызывает такие конформационные изменения, которые не позволяют ферменту превращать субстрат в продукт, но не влияют на сродство фермента к субстрату.
Схема неконкурентного ингибирования выглядит следующим образом:
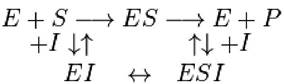
При взаимодействии фермента с неконкурентным ингибитором не изменяется значение константы Михаэлиса (Кm), а изменяется значение максимальной скорости (Vmax) ферментативной реакции.
2.5. Классификация и номенклатура ферментов
Международный союз биохимии и молекулярной биологии в 1961 г. разработал систематическую номенклатуру, согласно которой все ферменты разбиты на шесть основных классов в зависимости от типа катализируемой химической реакции.
Каждый фермент имеет общепринятое рабочее название и систематическое, применяемое для однозначной идентификации фермента. Рабочие названия образуются из объединения названия субстрата, типа реакции и окончания «-аза». Например, ЛАКТАТ + ДЕГИДРОГЕНизация + АЗА = ЛАКТАТДЕГИДРОГЕНАЗА. Систематическое название фермента формируется следующим образом: название субстратов + название типа химического превращения + аза. Та же лактатдегидрогеназа будет иметь систематическое название «L-ЛАКТАТ: НАД+ ОКСИДОРЕДУКТАЗА».
Каждый из шести классов ферментов имеет свои порядковый номер, строго закрепленный за ним.
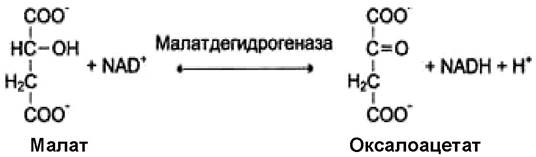
I. Оксидоредуктазы - ферменты, катализирующие окислительно-восстановительные реакции с участием двух субстратов (перенос электронов или атомов водорода с одного субстрата на другой). К числу оксидоредуктаз относятся дегидрогеназы, участвующие в энергетических процессах. В этот подкласс входят ферменты, катализирующие реакции дегидрирования (отщепления водорода). Все ферменты этой группы обладают высокой субстратной специфичностью. Пример реакции:
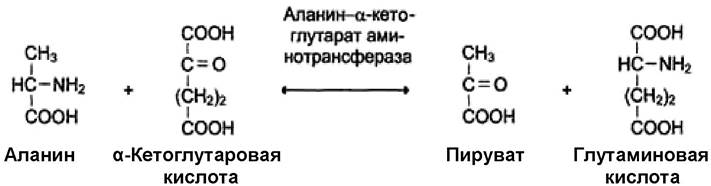
II. Трансферазы - ферменты, которые катализируют обратимые реакции внутримолекулярного или межмолекулярного переноса атомов или группы атомов. Подразделяются в зависимости от переносимой группы: аминотрансферазы, ацилтрансферазы, метилтрансферазы, фосфотрансферазы (киназы). Пример реакции:
III. Гидролазы - ферменты, катализирующие реакции гидролиза, т. е. реакции расщепления веществ с присоединением элементов воды по месту расщепляемой связи. Пример реакции:
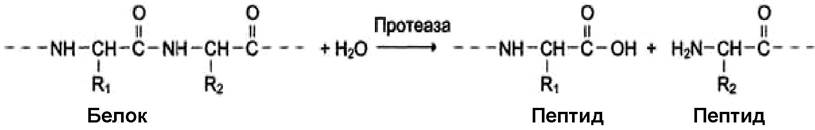
Наименование ферментов составляют по формуле «субстрат- гидролаза» или прямым присоединением к названию субстрата суффикса «аза», например, протеаза, липаза, фосфолипаза, рибонуклеаза. Для отдельных классов гидролаз применимы специальные термины, характеризующие гидролиз определенной химической связи: эстеразы, фосфатазы и др.
Гидролазы широко представлены в живых организмах. К ним относятся ферменты, участвующие в переваривании белков, углеводов и липидов в желудочно-кишечном тракте (протеазы, гликозидазы и липазы соответственно). Многие гидролазы применяются в пищевых технологиях.
IV. Лиазы - ферменты, катализирующие отщепление от субстратов негидролитическим путем определенной группы или присоединение молекулы воды по двойной связи. При отщеплении могут элиминироваться СО2, Н2О, NH2, SH2 и др.
Пример реакции:

V. Изомеразы - ферменты, которые катализируют различные внутримолекулярные превращения. Подразделяют в зависимости от типа реакции изомеризации. Например, фермент фосфоглюкоизомераза катализирует изомерные превращения гексоз:
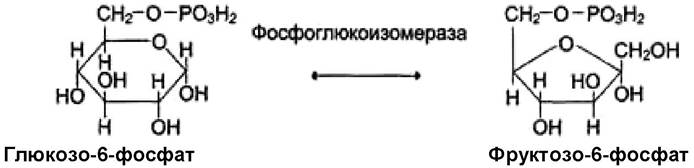
Изомеразы могут катализировать внутримолекулярные окислительно-восстановительные реакции, осуществляя взаимопревращения альдоз и кетоз, или перемещения двойных связей внутри молекулы. Пример реакции:

Когда изомеризация состоит во внутримолекулярном переносе группы, фермент называют «мутазой».
VI. Лигазы (синтетазы) - ферменты, которые катализируют реакции присоединения двух молекул с образованием ковалентной связи. Этот процесс энергозависимый и сопряжен с разрывом фосфоэфирной связи в молекуле АТФ или с разрывом макроэргических связей других соединений. При использовании энергии гидролиза АТФ ферменты называют лигазами, или синтетазами. Пример реакции:
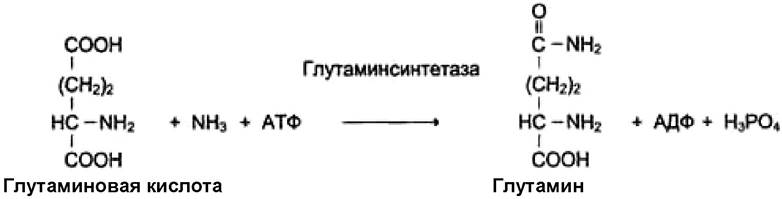
Если источником энергии служит любое другое макроэргическое соединение, кроме АТФ, ферменты называют синтазами. Пример реакции:
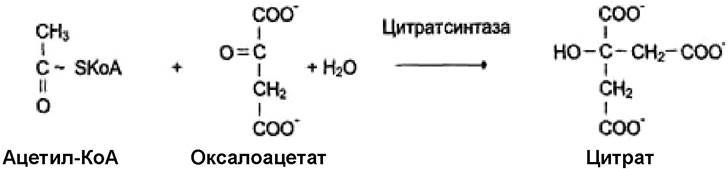
Разделение ферментов на классы строгое и не допускает произвольного изменения номеров. Каждый класс состоит из многочисленных подклассов и подподклассов с учётом химической группы субстрата, превращение которой катализирует фермент, донора и акцептора преобразуемых группировок и т. д. Например, гидролазы (класс 3) по типу гидролизуемых субстратов делятся на ферменты, катализирующие гидролиз эфиров карбоновых кислот (подкласс 3.1), гликозидов (подкласс 3.2), простых эфиров и тиоэфиров (подкласс 3.3), пептидов (подкласс 3.4) и т. д. В свою очередь подклассы делятся на подподклассы, а внутри подподклассов каждый фермент получает порядковый номер.
Номер фермента состоит из четырех групп цифр, разделенных точками. Первая цифра обозначает отнесение фермента к классу, вторая - к подклассу, третья - к подподклассу, четвертая - порядковый номер фермента. Например, номер фермента глюкозооксидазы по классификации РФ - КФ 1. 1. 3. 4.
2.6. Применение ферментов в пищевых технологиях
В пищевых технологиях используют в основном ферменты, присутствующие в пищевом сырье, которые поступают в организм человека при потреблении свежих фруктов и овощей, орехов, молока, сброженных и консервированных продуктов. В пищевых продуктах ферментов содержится мало: миллиграммы на килограмм продукта. При кулинарной и технологической обработке пищевых продуктов ферменты, как правило, инактивируются.
В кондитерском производстве применяется инвертаза дрожжей, превращающая сахарозу в глюкозу и фруктозу, предотвращая кристаллизацию сахарозы при высоких ее концентрациях.
В пивоварении для замены солода используют амилазы. Эти ферменты находят свое применение также при производстве патоки и растворимого крахмала. В хлебопечении амилазы на 30 % ускоряют процесс созревания теста, улучшают качество хлеба, предотвращая процесс черствения.
При переработке молока ферменты используют в нескольких технологических процессах. При производстве сыра одной из основных стадий является коагуляция молока, которая осуществляется при помощи ренина.
Целлюлазы используют при приготовлении растворимого кофе, а также при обработке цитрусовых. Кислая липаза применяется в хлебопечении; она катализирует процесс образования моноглицеридов, препятствующих очерствению хлеба.
Ферменты - вещества белковой природы и поэтому неустойчивы при хранении, а также чувствительны к тепловым воздействиям. Кроме того, ферменты не могут быть использованы многократно из-за трудностей в отделении их от реагентов и продуктов реакции. Решить эти проблемы помогает создание иммобилизованных ферментов.Термин «иммобилизованные ферменты» узаконен в 1971 г. и означает любое ограничение свободы передвижения белковых молекул в пространстве. Иммобилизовать ферменты можно связыванием с нерастворимыми носителями, а также присоединением к растворимому полимеру. Для получения иммобилизованных ферментов используются как органические, так и неорганические носители, к которым предъявляются определенные требования, включающие как физикохимические, так и экономические характеристики. Для иммобилизации ферментов наиболее широко используются природные полисахариды и синтетические носители полиметильного типа.
Преимущества иммобилизованных ферментов перед нативными предшественниками:
- гетерогенный катализатор легко отделим от реакционной среды, что дает возможность остановить реакцию в любой момент, использовать фермент повторно, а также получать чистый от фермента продукт;
- ферментативный процесс с использованием иммобилизованных ферментов можно проводить непрерывно, регулируя скорость катализируемой реакции и выход продукта;
- модификация фермента целенаправленно изменяет его свойства, такие как специфичность (особенно в отношении макромолекулярного субстрата), зависимость каталитической активности от рН, ионного состава и других параметров среды, стабильность к денатурирующим воздействиям;
- можно регулировать каталитическую активность иммобилизованных ферментов путем изменения свойств носителя действием физических факторов, таких как свет и звук.
Промышленные процессы с применением иммобилизованных ферментов внедрены, прежде всего, в пищевую и фармацевтическую промышленность. В пищевой промышленности с участием иммобилизованных ферментов идут крупномасштабные процессы получения глюкозы, яблочной и аспарагиновой кислоты, оптически активных L-аминокислот, диетического безлактозного молока, сахаров из молочной сыворотки и др.
Глюкозоизомераза, иммобилизованная на целлюлозном носителе, применяется для получения глюкозо-фруктозных сиропов с преимущественным содержанием фруктозы.
Крупномасштабным производством является получение глюкозы из крахмала с использованием иммобилизованной амилоглюкозидазы в проточных перемешиваемых реакторах.
Для просветления пива используют протеиназы, в частности папаин, иммобилизованный на хитине.
Для удешевления процесса производства сыра в ряде случаев применяют бактериальные реннины, иммобилизованные на нерастворимых носителях.
Отходом при производстве сыра является молочная сыворотка, содержащая большое количество лактозы. Последняя содержит галактозу и глюкозу, представляющую большую пищевую ценность. Однако получение глюкозы из лактозы при помощи растворимой лактазы нетехнологично, поэтому был разработан метод гидролиза лактозы, при помощи, иммобилизованной на ацетилированной целлюлозе лактазы. Для стабилизации молока его обрабатывают протеиназами. Так, обработанное иммобилизованным трипсиноммолоко меньше подвержено окислению и в течение двух недель не утрачивает своего вкуса.
Применение иммобилизованных ферментов в промышленности получило название инженерной энзимологии. Примеры свидетельствуют об огромных возможностях инженерной энзимологии в различных областях народного хозяйства. Например, иммобилизованная β-галактозидаза, присоединенная к магнитной стержню- мешалке, позволяет получить диетический молочный продукт, который могут потреблять люди с наследственной непереносимостью лактозы. Обработанное таким образом молоко, кроме того, хранится в замороженном состоянии значительно дольше и не подвергается загустеванию.
В настоящее время налажено промышленное производство генетически модифицированных микроорганизмов-продуцентов рекомбинантных ферментов. Например, ген, ответственный за выработку фермента химозина, выделенный из эукариотического организма, внедряют в геном бактерии Escherihia coli, которая становится продуцентом данного фермента. Бактерии Bacillus subtilus используют как продуценты рекомбинантного фермента ацетолактатдекарбоксилазы, который находит применение в пивоваренной, спиртовой и винодельческой промышленности.
Рекомбинантные ферменты отличаются высокой чистотой, что имеет особое значение в пищевых технологиях. Например, использование свободных от протеазной активности амилаз в хлебопечении позволяет улучшить реологические свойства теста, поскольку не происходит разрушения структуры белков клейковины.
Продолжается поиск новых возможностей использования ферментов в пищевой промышленности. Основными направлениями исследования являются:
✵ модификация свойств индивидуальных ферментов с целью повышения их активности и удешевления целевых продуктов;
✵ скрининг новых микроорганизмов-продуцентов ферментов;
✵ получение новых рекомбинантных ферментов с заданными свойствами;
✵ применение ферментативных реакций для получения ценных пищевых ингредиентов и биологически активных веществ;
✵ разработка пищевых нанотехнологий с использованием ферментов.
Современные методы модификации ферментов позволяют увеличивать стойкость ферментов к действию различных химических реагентов и ингибиторов, рН, температурному воздействию; изменять рН оптимума ферментов, их субстратную специфичность и связывающие свойства; регулировать предпочтения определенных металлов-кофакторов и каталитические свойства ферментов.
Вопросы и задания для самопроверки
1. Дайте определение ферментов.
2. Приведите общие свойства и отличия ферментов от катализаторов небелковой природы.
3. Расскажите о строении ферментов.
4. Охарактеризуйте активный центр фермента. Что такое аллостерический центр фермента? Ответ иллюстрируйте схемой.
5. В чем состоят функции контактного и каталитического участков активного центра фермента?
6. Приведите схему, демонстрирующую механизм катализа.
7. В чем отличие энергии активации ферментативной реакции?
8. Опишите теорию ферментативного катализа Михаэлиса - Ментен.
9. Приведите график зависимости скорости ферментативной реакции от концентрации фермента.
10. Опишите график зависимости скорости ферментативной реакции от концентрации субстрата.
11. Опишите физический смысл константы Михаэлиса.
12. Какая зависимость позволяет графически определить константы Михаэлиса?
13. Нарисуйте и прокомментируйте график зависимости скорости ферментативной реакции от концентрации фермента.
14. Приведите уравнение Лайнуивера-Бэрка как результат преобразования уравнения Михаэлиса-Ментен.
15. Какие кинетические характеристики ферментативной реакции можно определить по графику уравнения Лайнуивера-Бэрка?
16. Назовите принцип международной классификации ферментов.
17. Дайте общую характеристику ферментов класса оксидоредуктаз.
18. Дайте общую характеристику ферментов класса трансфераз.
19. Дайте общую характеристику ферментов класса гидролаз.
20. Дайте общую характеристику ферментов класса лиаз.
21. Дайте общую характеристику ферментов класса изомераз.
22. Дайте общую характеристику ферментов класса лигаз.
23. Приведите примеры использования гидролаз в молочной промышленности.
24. Приведите примеры использования гидролаз в хлебопечении.
25. Приведите примеры использования гидролаз в переработке мяса.
26. Какие ферменты используются для получения глюкозы из крахмала?
27. Что такое иммобилизованные ферменты?
28. Какие носители используют для иммобилизации ферментов?
29. Приведите примеры использования иммобилизованных ферментов в пищевых технологиях.
30. Что такое рекомбинантные ферменты?