Фармакогнозія з основами біохімії рослин - Ковальов В. М. 2004
Спеціальна частина
Серцеві глікозиди (кардіостероїди)
Серцеві глікозиди — велика група глікозидів, похідних циклопентанопергідрофенантрену, які вибірково діють на серцевий м’яз.
Серед природних глікозидів серцеві глікозиди займають особливе місце, оскільки не мають синтетичних аналогів. Рослини, які містять серцеві глікозиди, а також одержані з них препарати, є головними засобами при лікуванні серцево-судинної недостатності.
Характерною ознакою серцевих глікозидів є специфічна дія на серцевий м’яз: у малих дозах вони збільшують його скорочення і поліпшують роботу серця, у великих — навпаки, пригнічують роботу міокарда і кінець кінцем викликають зупинку серця. На центральну нервову систему в малих дозах серцеві глікозиди діють заспокійливо.
З давніх-давен рослини, що містять серцеві глікозиди, використовували для лікування серцевих захворювань. Луківку застосовували як серцевий і сечогінний засіб у Стародавньому Єгипті та Римі. У глибокій давнині народи Африки вживали корінь харгу, або гомфокарпусу, що зветься «корінь узару», при захворюваннях серця. Наперстянка як лікувальний засіб була відома в Англії з XI ст.
Перші досліди з вивчення структури серцевих глікозидів було розпочато в XIX ст. У 1913 р. опубліковано роботу німецького вченого Ванрауса, яка містила відомості про структурні особливості серцевих глікозидів. Далі з’явилися роботи американця Джекобса, швейцарця Чеше, німця Штолля, котрі розширили знання про серцеві глікозиди.
У створенні лікарських засобів із серцевих глікозидів брали участь: Д. Г. Колесников, Я. І. Ходжай, М. А. Ангарська, В. Т. Чорнобай, I. X. Макаревич, М. Ф. Комісаренко (Державний науковий центр лікарських засобів, Харків), Н. К. Абубакіров (Інститут хімії природних речовин АН Узбекистану. Ташкент), І. Т. Кутателадзе, Е. П. Кемертелідзе (Інститут фармакохімії Грузії. Тбілісі), А. Д. Турова (Інститут лікарських рослин Росії. Москва) та ін.
Будова та класифікація
Аглікони серцевих глікозидів є стероїдами, але на відміну від інших сполук цього класу вони мають специфічну просторову орієнтацію молекули. Кільця A/В та С/D у кардіостероїдів знаходяться в цис-положенні. а кільця В/С — у транс-положенні. Таке розташування кілець відрізняє серцеві глікозиди від інших природних стероїдів, в яких кільця С/D займають транс-положення.
Кардіостероїди за хімічною будовою мають бутенолідне п'ятичленне ненасичене лактонне кільце, або кумалінове — двічі ненасичене шестичленне лактонне кільце. Саме наявність лактонного кільця обумовлює серцеву дію. Відсутність, розрив або ізомеризація лактонного кільця веде до втрати фізіологічної активності. Серцеві глікозиди за характером бічного ланцюга у С-17 поділяються на дві групи:
карденоліди (група наперстянки, строфанта) мають у С-17 ненасичене п'ятичленне лактонне кільце;
буфадієноліди (група морозника, луківки) мають у С-17 шестичленне ненасичене кільце з двома подвійними зв'язками.
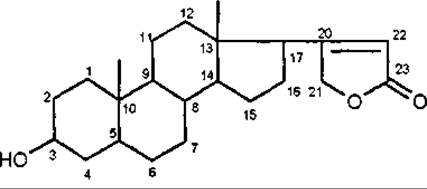
Карденолід

Буфадієнолід
Більш поширені карденоліди, які зустрічаються тільки в рослинах. Буфадієноліди зустрічаються як у рослинних, так і у тваринних організмах.
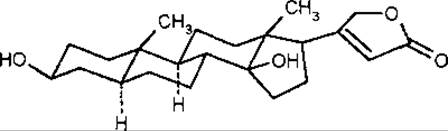
Лактонне кільце в карденолідах може знаходитися в а (17ßH)- або ß (17аН)-положеннях. (Замісники, що знаходяться над загальною площиною кільцевої системи, позначаються ß, а під — а.) У природі в більшості випадків зустрічаються карденоліди з розташуванням лактонного кільця в 17ß-пoлoженнi, проте в деяких рослинах знайдені карденоліди з 17а-розташуванням лактонного кільця. За конфігурацією сполучення кілець A/В карденоліди і буфадієноліди поділяють на два ряди:
ряд холестану (транс-А/В ряд, або 5а-ряд). до якого відноситься узаригенін;
ряд копростану (цис-А/В ряд. або 5ß-ряд), до якого відноситься дигітоксигенін.
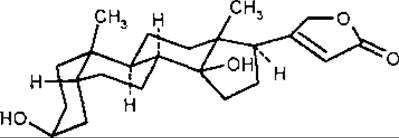
За стереохімією стероїдного ядра буфадієноліди однакові з карденолідами. Поряд зі вказаними вище замісниками та місцями їх приєднання деякі буфадієноліди мають гідроксильну групу у С-8 та ацетилгідроксильну групу у С-6.
За класифікацією, запропонованою Баумгартеном, серцеві глікозиди в залежності від замісників у С-10 (С-19)-положенні поділяють на три групи: з альдегідною групою, зі спиртовим та з метильним радикалом.
Крім того, у положенні С-13 завжди знаходиться метильна група, гідроксили — у С-3 та С-14, рідше у С-5, С-11, С-12. С-18. Гідроксильна група у С-16 часто етерифікується мурашиною (гіпоксигенін). оцтовою (олеандрогенін) та ізовалеріановою (адигенін) кислотами. Епоксидні групи зустрічаються в положеннях С7 — С8 (тангеногенін), С8 — С14 (адиреригенін), С11 — С12 (цербертигенін) і мають ß-конфігурацію. Карденолідів з подвійним зв’язком у молекулі небагато, наприклад канаригенін. гірканогенін.
Вуглеводну частину серцевих глікозидів найчастіше утворюють D-глюкоза, D-фруктоза та D-ксилоза. Специфічними для кардіостероїдів є 2,6 дезоксисахара — D-дигітоксоза, D-цимароза, D-олеандроза, D-дигіталоза та ін.
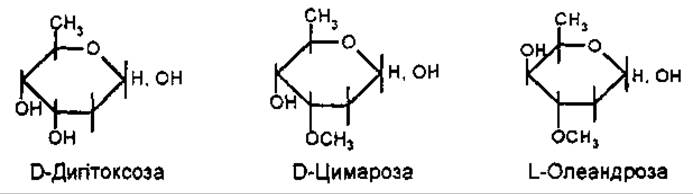
За розміром окисного циклу вуглеводи є піранозидами. Відомий поки що один фуранозид, який входить до складу скорпіозиду.
Біосинтез
Вважають, що обидва типи кардіостероїдів утворюються з ß-сітостерину за рахунок зміни структури бічного ланцюга у С-17.
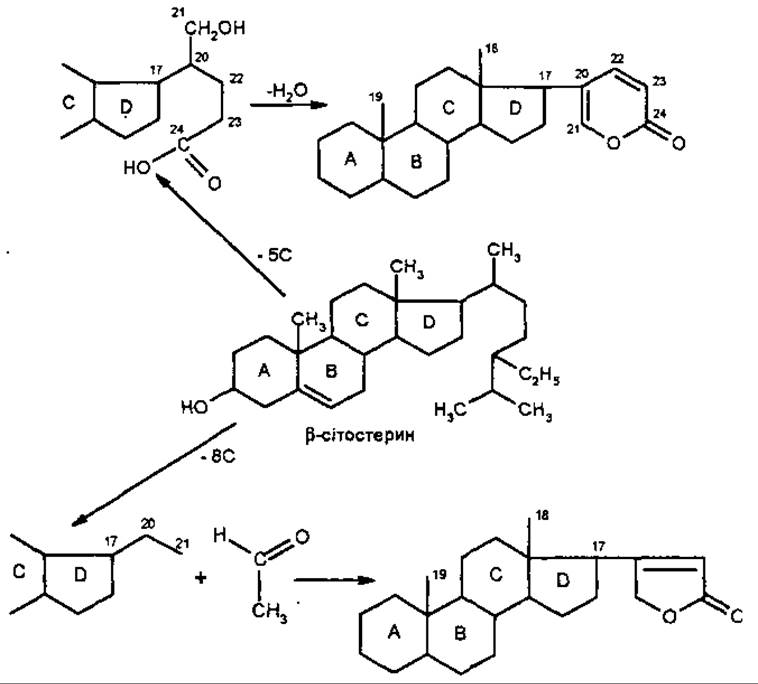
Поширення та локалізація
У світовій флорі з 434 родин квіткових рослин кардіотонічні глікозиди знайдено у 14 родинах і 34 родах, до яких належать близько 300 видів. Більшість з них синтезують глікозиди, містять карденоліди. Тільки в рослинах родин Alliaceae, Hyacinthaceae, Liliaceae, Iridaceae та Meliaceae ідентифіковані буфадієноліди. Крім рослин, буфадієноліди цис-A/B ряду (латин, bufo — жаба) знайдені в отруйних виділеннях шкірних залоз жаб.
У 1978 р. Є. Рейхштейн із співробітниками знайшли в деяких комах, які паразитують на африканських видах ваточника (Asclepias), карденоліди цис-A/В ряду. Ці комахи самі не виробляють отруйні речовини, але, поїдаючи рослини, які містять серцеві глікозиди, накопичують їх для захисту від ворогів.
Наявність серцевих глікозидів виявлено у таких родинах і родах: Scrophulariaceae (Digitalis), Convallariaceae, Hyacianthaceae (Ornithogalum, Scilla, Bowiea), Apocynaceae (Strophanthus, Nerium), Ranunculaceae (Adonis, Helleborus), Brassicaceae (Erysimum), Fabaceae (Coronilla), Asclepiadaceae (Asclepias, Periploca), Moraceae та ін.
Локалізуються вони в різних органах рослини — насінні, листі, стеблах, кореневищі, коренях, корі та ін. Вміст їх змінюється відповідно до еколого-географічних умов, вегетаційного періоду, стану рослини (свіжа або висушена) тощо.
Фізико-хімічні властивості
Серцеві глікозиди — безбарвні або білі кристалічні, рідше аморфні речовини без запаху, гіркі на смак, мають певну температуру топлення (100-270 °С), оптично активні, багато з них флуоресціюють в УФ-світлі. Більшість малорозчинна у воді, добре розчиняється у водних розчинах метилового та етилового спиртів. Глікозиди з довгим вуглеводним ланцюгом краще розчиняються у воді та водних розчинах спиртів, а аглікони — в органічних розчинниках.
Серцеві глікозиди схильні до гідролізу. Він може бути кислотним та ферментативним. У лужному середовищі йде деструкція агліконової частини молекули (розмикання лактонного угрупування), що призводить до втрати кардіотонічної дії.
Сахара карденолідних глікозидів є специфічними: вони не відщеплюються глікозидазами, виняток становлять лише ферменти виноградного равлика. D-Глюкофуранозиди стійкі до ферментативного розщеплення на відміну від D-глюкопіранозидів; швидкість гідролізу залежить від структури аглікону.
На стійкість глікозидного зв’язку при кислотному гідролізі впливає розмір окисного циклу сахару. Фуранозиди гідролізуються значно швидше, аніж піранозиди Глікозиди 2-дезоксисахарів менш стійкі до гідро-порівняно з глікозидами звичайних сахарів.
Методи виділення і дослідження
Екстракція. Методи виділення серцевих глікозидів із рослин мають більш як 100-річну історію і досі удосконалюються. Сучасна схема екстракції така: подрібнення сировини, знежирення її бензином або петролейним ефіром, екстракція 30-70 % етанолом. згущення екстракту, переведення глікозидів у водний або водно-спиртовий розчин; висадження смол і хлорофілу; екстракція глікозидів органічними розчинниками, що не змішуються з водою; випарювання; очищення водно-спиртового розчину ацетатом свинцю або гідроксидом алюмінію; витягування глікозидів із водного розчину органічними розчинниками різної полярності (діетиловий ефір, хлороформ, суміш хлороформу-етанолу 3:1 — 2:1); хроматографічне розділення та кристалізація. Процес багатостадійний, але виправдовує себе якістю очищення серцевих глікозидів від численних супутніх сполук.
Ідентифікація. Для визначення серцевих глікозидів частіш за все використовують три групи кольорових реакцій: на стероїдне ядро, лактонне кільце, вуглеводний компонент.
Стероїдне ядро. Використовують реакцію Лібермана — Бурхарда. З реактивом Чугаєва (хлорид цинку і ацетилхлорид в оцтовій кислоті) утворюється рожеве забарвлення з максимумом поглинання 562 нм. Карденоліди, які містять дієнову групу або здатні її утворювати під впливом трихлороцтової кислоти, дають позитивну реакцію Розенхейма. Стероїдна структура може бути доведена кольоровими реакціями із сірчаною і фосфорною кислотами.
Бутенолідне кільце. Проводять реакції з ароматичними нітро-похідними в лужному середовищі: реакції Легаля (з натрію нітро-прусидом), Раймонда (з м-динітробензолом). Кедде (з 3.5-динітробензойною кислотою). На кумалінове кільце специфічних реакцій не знайдено. Для ідентифікації буфадієнолідів знімають УФ-спектр, де вони мають характерну смугу поглинання при λ-300 нм.
Дезоксисахара виявляють реакцією Келлера — Кіліані. Реакція позитивна, якщо в препараті або витяжці з рослинної сировини 2-дезоксисахар знаходиться у вільному стані або займає кінцеве положення у молекулі глікозиду. Вільні 2-дезоксисахара з нітро-фенілгідразином і лугом утворюють блакитне забарвлення. Виявляють 2-дезоксисахара й на папері зі спиртовим розчином n-диметиламінобензальдегіду і фосфорною кислотою.
В аналізі серцевих глікозидів використовують УФ-, ІЧ-, МАС-, та ЯМР-спектроскопію. Так. УФ-спектроскопія дозволяє встановити вид лактонного кільця, наявність подвійних зв'язків у стероїді, виявити наявність та положення замісників у ньому.
Кількісне визначення. Всі методи кількісної оцінки серцевих глікозидів можна поділити на дві групи: біологічні та фізико-хімічні.
Біологічні методи. Біологічну активність серцевих глікозидів визначають на лабораторних тваринах: котах, жабах, голубах. Її порівнюють із активністю стандартних зразків і виражають в одиницях дії (котячих, жаб’ячих та голубиних).
Стандартними зразками при дослідженні сировини є спеціально виготовлені спиртові екстракти, які містять суміш глікозидів і очищені від супутніх речовин.
За одиницю дії (1 КОД. 1 ЖОД. 1 ГОД) прийнята найменша кількість досліджуваного об’єкта (1 мг речовини або 1 мл витягу з рослини), яка викликає систолічне зупинення серця у тварин протягом 1 год.
Використовують жаб трав’яних, озерних та ставкових, переважно самців, масою 25-40 г. Котів беруть обох статей, здорових, масою 2,5—3.5 кг. Біологічний метод стандартизації складний, трудомісткий. не завжди доступний, має дуже малу точність (від 10 до 25 %), але є незамінним при аналізі галенових препаратів та рослинної сировини. Фармакопея вимагає перевіряти біологічну активність листя наперстянки та препаратів з неї, препаратів наперстянки шерстистої; трави горицвіту та препаратів з неї; трави, листя, квіток конвалії, препаратів, складних лікарських форм, до складу яких входить настойка конвалії; насіння строфанту та препаратів з нього; трави, насіння жовтушника сивіючого та препаратів з них.
Фізико-хімічні методи. Титриметричний метод застосовують для серцевих глікозидів, які мають карбонільну групу. При взаємодії гідроксиламіну хлориду з карбонільною групою виділяється хлористоводнева кислота, яка зв’язується діетиламіном, а надлишок останнього титрується розчином хлорної кислоти в метанолі. Цей метод об’ємного титрування серцевих глікозидів був запропонований М. О. Казаріновим та Н. П. Дзюбою (ДНЦЛЗ, Харків).
Полярографічний метод грунтується на здатності карденолідів і буфадієнолідів відновлюватися на ртутно-крапельному електроді.
Спектрофотометричний та колориметричний методи основані на визначенні оптичної густини розчинів серцевих глікозидів з різними хромогенними реагентами.
Комбіновані методи полягають у тому, що спочатку серцеві глікозиди поділяють хроматографічно (паперова, тонкошарова або колонкова хроматографія) з наступним спектрофотометричним або колориметричним визначенням їх.
Сушіння та зберігання рослинної сировини, що містить кардіостероїди
Ще в 30-х рр. швейцарський вчений А. Шталь висунув гіпотезу про те, що серцеві глікозиди знаходяться в рослинах у вигляді складніших сполук, аніж ті, які взагалі вилучають. Вважалося, що ферменти під час сушіння, зберігання і виділення глікозидів з рослинної сировини відщеплюють від первинних сполук (генуїнних глікозидів) сахара, які перетворюються на менш складні речовини, біологічна дія яких слабкіша, ніж у нативних глікозидів. Тож рослинну сировину, яка містить глікозиди, сушили швидко при температурі 50-60 °С, щоб звести до мінімуму дію ферментів.
Пізніше, в 60-70-х рр., дослідження Н. К. Абубакірова, Г. П. Генкіна та інших довели, що вміст К-строфантину-ß у свіжих коренях кендиря та траві горицвіту менший, аніж вміст його в тій самій сировині, але при повільному сушінні. Вони зробили висновок, що при повільному сушінні відбувається синтез К-строфантину-ß з цимарину. Це знайшло підтвердження в подальших роботах, які довели, що під час повільного сушіння листків наперстянки шеретистої різко (на 50-80 %) збільшується вміст нативних ланатозидів А, В, С.
У зв’язку з високою токсичністю кардіотонічних речовин лікарську рослинну сировину та препарати, які містять їх, слід зберігати з обережністю (за списком Б), окремо від іншої сировини, в сухому, захищеному від прямих сонячних променів місці. Один раз на рік сировину і препарати стандартизують. На етикетках повинні бути вказані: дата аналізу і кількість одиниць дії в 1 г сировини. Чисті глікозиди зберігають за списком А.
Біологічна дія та застосування
Виявлено, що характер та механізм дії різних серцевих глікозидів на серцево-судинну систему взагалі однаковий, але кожному з них властиві й деякі особливості: сила, тривалість та швидкість прояву дії, кумуляція та ін.
Кардіотонічний ефект розвивається внаслідок прямої дії на міокард. Кардіостероїди змінюють всі його функції:
підвищують скорочення серця (позитивна інотропна дія);
посилюють тонус міокарда (позитивна тонотропна дія);
зменшують частоту серцевих скорочень (негативна хронотроп- на дія);
погіршують провідність міокарда (негативна дромотропна дія);
посилюють збудливість міокарда (позитивна батмотропна дія).
У діапазоні терапевтичних доз виникають лише перші три ефекти. Саме вони зумовлюють клінічну цінність серцевих глікозидів. У той же час два останні ефекти містять ознаки передозування, вказують на токсичну дію глікозидів на міокард. Крім кардіотонічної дії, серцеві глікозиди мають цитостатичний ефект, сприятливо впливають на центральну нервову систему.
Препарати серцевих глікозидів призначають хворим на хронічну серцеву недостатність з порушенням кровообігу.
Зв’язок між хімічною будовою і фармакологічною дією серцевих глікозидів
Різноманітність дії (терапевтичної і токсичної) стероїдних лактонів зумовлена декількома особливостями їх будови. По-перше значення має природа лактонного кільця у С-17, далі — наявність замісників, подвійних зв’язків, природа вуглеводного компонента, стереохімічні особливості молекули.
У медицині знайшли застосування серцеві глікозиди 12 агліконів. Шість із них (гітоксигенін, дигітоксигенін, дигоксигенін, дигінатигенія, олеандрогенін й периплогенін) у С-10 містять метальний радикал, що зумовлює кумулятивний ефект. Два аглікони — строфантидол та уабагенін у С-10 мають метоксильну групу; чотири аглікони — альдегідну групу (адонітоксигенін, строфанти- дин, канногенін та геллебрігенін). Глікозиди з карбоксильною групою у С-10 положенні втрачають кардіотонічну дію.
Зміна орієнтації лактонного кільця з 17ß- на 17а-конфігурацію, відновлення його подвійного зв’язку або утворення ізокарденолідів призводить до різкого зниження кардіотонічної активності.
Суттєвий вплив на біологічну активність має конформація стероїдного ядра, кількість, природа та положення замісників у ньому. Глікозиди з цис-сполученням кілець А і В активніші, ніж трансформи. Гідроксильна група у С-11а і C-12ß положеннях підвищує біологічну активність, а у C-7ß- або C-16ß-пoлoжeнняx — знижує її.
Порівняння ряду глікозидів з однаковим агліконом і різними сахарами доводить, що природа вуглеводного залишку суттєво впливає на біологічну активність. Глікозиди з сахарним залишком L-ряду значно активніші за глікозиди із залишком D-ряду. Біологічна активність агліконів буфадієнолідного ряду вища, але дія їх короткочасніша. Монозиди буфадієнолідів менш активні, ніж карденолідів, а біозиди, навпаки, активніші у буфадієнолідів.
Найбільшу кардіотонічну активність мають серцеві глікозиди. які конформаційно найменш стабільні. Кардіостероіди з транс-конфігурацією кілець A/В у 3.3 раза менш активні за глікозиди, що мають цис-конфігу рацію. І навпаки, у разі цис-конфігурації С/D кілець серцевих глікозидів активність їх значно вища, ніж при транс-конфігурації.
Малоактивні карденоліди і буфадієноліди, які у структурі містять карбоксильні групи. Активність кардіостероїдних агліконів залежить від ступеня їх полярності: чим вищий ступінь полярності, тим вища активність. Підвищує активність і знижує кумуляцію альдегідна група при С-10.
Відомості про препарати серцевих глікозидів наведені в табл. 15 Додатків.