Химия белка. Структура, свойства, методы исследования - Шендрик А.Н. 2022
Аминокислоты
Аминокислоты
Групповые реагенты на аминокислоты
Нингидрин. В качестве группового локализующего агента применяется 0,25%-ный (масс./об.) раствор нингидрина в ацетоне. Нингидрин, как сильный окислитель, приводит к дезаминированию аминокислоты с образованием аммиака, двуокиси углерода, соответствующего альдегида и восстановленной формы нингидрина:
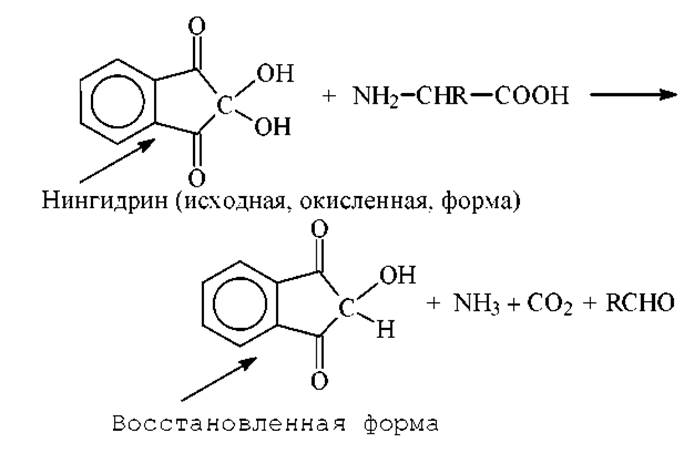
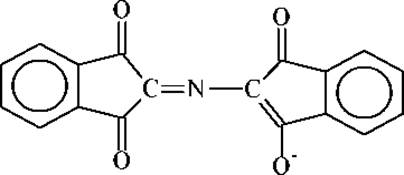
Восстановленная форма нингидрина реагирует далее с избытком нингидрина и аммиаком, образуя продукт сине-фиолетового цвета с λmах = 580нм. Оптическая плотность при этой длине волны является практически линейной функцией числа аминогрупп. Исходя из этого, на основе нингидриновой реакции разработан фотоколориметрический метод количественного определения аминокислот. Сине-фиолетовый продукт реакции имеет следующее строение:
Если реакцию с нингидрином проводить при рН=1-5, то количество свободной аминокислоты можно определить по объему выделившейся двуокиси углерода. Пептиды и первичные амины также дают сине-фиолетовое окрашивание с нингидрином. Однако, СО2 в этих случаях не образуется. Это позволяет проводить анализ аминокислот в присутствии пептидов. Пролин и оксипролин образуют с нингидрином ярко желтый продукт (λmах = 440 нм.), что позволяет анализировать смеси амино- и иминокислот без их предварительного разделения.
После проведения нингидриновой реакции и разделения смеси методом хроматографии в тонких слоях пятна можно проявлять нагреванием при 100°С в течение 5 мин или, с целью получения более светлого фона, выдерживанием при комнатной температуре в течение нескольких часов. Аминокислоты дают пурпурные пятна; гистидин и глицин красно-серые; фенилаланин, тирозин и аспарагиновая кислота синие; триптофан коричневые; аспарагин грязно-желтые; пролин желтые. Чувствительность метода варьирует в диапазоне от 0,2 мкг для глицина до 2 мкг для гистидина.
Для идентификации по окраске используют смесь 50 мл 0,1%-ного раствора нингидрина в этаноле + 2 мл коллидина. В некоторых работах рекомендуется добавлять 10 мл СН3СООН. Чем ниже чистота коллидина, тем лучше окраска. Хроматограмму нагревают, наблюдая за развитием окраски. Окраску, даваемую каждой аминокислотой, лучше всего определить экспериментально, но следует особо отметить, что тирозин меняет окраску через несколько секунд после ее появления, и пятна многих других аминокислот спустя несколько минут приобретают пурпурную и синюю окраску.
Некоторые исследователи предпочитают измененный вариант приведенных выше методик, с участием иона меди. Это диктуется необходимостью достичь такого различия в окраске, чтобы можно было идентифицировать все аминокислоты. В соответствии с этой методикой готовят два раствора: 1) 0,2%-ный раствор нингидрина в 50 мл этанола + 10 мл уксусной кислоты + 2 мл коллидина; 2) 1%-ный раствор Сu(NO3)2∙3H2O. Хроматограмму опрыскивают свежеприготовленной смесью 25 мл раствора (1) и 1,5 мл раствора (2); высушивают и нагревают в течение 1,5-2 мин при 105°С. Таким же образом обрабатывают пластинки ТСХ. Пластинки высушивают, опрыскивают реагентом и подогревают так, чтобы за окраской можно было наблюдать по мере ее появления.
Для обнаружения N-метиламинокислот (которые обычно дают очень слабую окраску с нингидрином) в присутствии свободных аминокислот используют специальный реагент. Смешивают равные объемы 0,33%-ного раствора нингидрина в трет-бутаноле и смеси ледяная уксусная кислота-вода-пиридин (1: 5 : 5). Опрыскивают и нагревают 10-15 мин при 100-110°С. Первичные амины и N-метиламинокислоты дают пурпурные пятна сравнимой интенсивности. При опрыскивании водным раствором нингидрина, приготовленным путем растворения нингидрина в н-бутаноле, насыщенном водой и содержащем 2% уксусной кислоты, N-метиламинокислоты дают пятна слабой интенсивности.
Окрашенная нингидрином бумага выцветает под действием воздуха и света. Для более длительного сохранения окраски можно дополнительно опрыскать реагентом, содержащим Cu(CNO3)2. К 1 мл насыщенного раствора Cu(NO3)2 добавляют 0,2 мл 10%-ной HNO3 и доводят до 100 мл 95%-ным этанолом. Лучше всего бумагу покрыть пленкой, погрузив ее в насыщенный раствор полиметилметакрилата в хлороформе.
Флуорескамин. Этот реагент реагирует с первичными аминогруппами аминокислот и пептидов. Хроматограмму опрыскивают 0,05%-ным раствором флуорескамина в ацетоне и наблюдают флуоресцирующие пятна. Предварительное и последующее опрыскивание хроматограммы 10%-ным раствором триэтиламина в метиленхлориде повышает чувствительность методики (до 1 нмоль), а также устойчивость образующихся флуоресцирующих пятен. Пятна пролина и гидроксипролина медленно проявляются при нагревании в течение 3 ч при 110°С или через два дня при комнатной температуре. В другом варианте методики бумагу или пластинку обработанную флуорескамином, вымачивают последовательно в 0,1 М растворе уксусной кислоты в ацетоне и 0,1 М растворе N-хлоросукцинимида в ацетоне. Выдерживают 5 мин, промывают ацетоном и нагревают 5-10 мин при 110°С.
Изатин. Один из недостатков нингидрина состоит в том, что пролин может быть легко “замаскирован” пятнами других аминокислот. Были описаны два реагента, лишенные этого недостатка и в то же время обеспечивающие широкий диапазон цветов при хроматографическом определении аминокислот.
1. 1 г. изатина + 1,3 г. ацетата цинка растворяют в 70-80 мл нагретого изопропанола. По охлаждении добавляют 1 мл пиридина.
2. 1 г изатина + 1,5 г ацетата цинка растворяют в 93 мл нагретого изопропанола + 3 мл воды. По охлаждении добавляют 1 мл ледяной уксусной кислоты.
Эти реагенты дают наборы пятен, слегка различающиеся по окраске. В обоих случаях хроматограмму опрыскивают, высушивают и прогревают при 80-85°С в течение 10 мин. Фон может быть отмыт без изменения окраски аминокислотных пятен быстрым ополаскиванием хроматограммы водой.
Наблюдения в УФ-лучах. Возможны следующие методики анализа аминокислот с использованием УФ-облучения.
1. Аминогруппы могут реагировать со свободными альдегидными группами, содержащимися в хроматографической бумаге. Образующиеся основания Шиффа дают синюю флуоресценцию в УФ свете. Хроматограмму нагревают при 100°С в течение 30 мин. N-Замещенные аминокислоты дают темные пятна. Чувствительность немного ниже, чем при использовании нингидрина, некоторые аминокислоты могут разрушаться.
2. Хроматограмму опрыскивают 0,2%-ным раствором салицилового альдегида в ацетоне. Образующиеся основания Шиффа могут разлагаться при опрыскивании водой и под действием воздуха.
3. Хроматограмму пропитывают 0,01%-ным раствором 1,2-нафтохинон-4-сульфоната - (реагент Фолина) в метаноле. Нагревают при 110-120°С в течение 10 мин.
Иод. Метод, не вызывающий разрушения аминокислот, но неспецифичный. Бумагу или тонкослойную пластинку обрабатывают парами I2 (от нескольких кристаллов) в стеклянном сосуде. Через 10-30 с хроматограмму вынимают и отмечают карандашом быстро исчезающие коричневые пятна. В другом варианте: бумагу можно опрыскать петролейным эфиром (фракция с т.кип. 60 - 80°С), насыщенным I2.
Хлор Пригоден для определения аминокислот, N-блокированных аминокислот и пептидов. Тест специфичен для соединений, содержащих связь N- С, поэтому такие растворители, как пиридин и коллидин, должны быть удалены. Бумагу или тонкослойную пластинку промывают эфиром, а затем смесью (1:1) ацетон-этанол (в этих растворителях аминокислоты и пептиды нерастворимы). Обрабатывают в течение 5 мин Сl2, для чего помещают над ванночкой, в которой находятся равные объемы насыщенного раствора КМnО4 и 10%-ной НСl. Хроматограмму вынимают, проветривают для удаления избытка Сl2 и погружают в смесь равных объемов насыщенного раствора о-толуидина в 2%-ной уксусной кислоте и 0,05 М раствора KI. На светлом фоне возникают сине-черные пятна. Фон может быть уменьшен, если бумагу, обработанную хлором, перед помещением в раствор о-толуидина обработать в течение 10с парами аммиака.
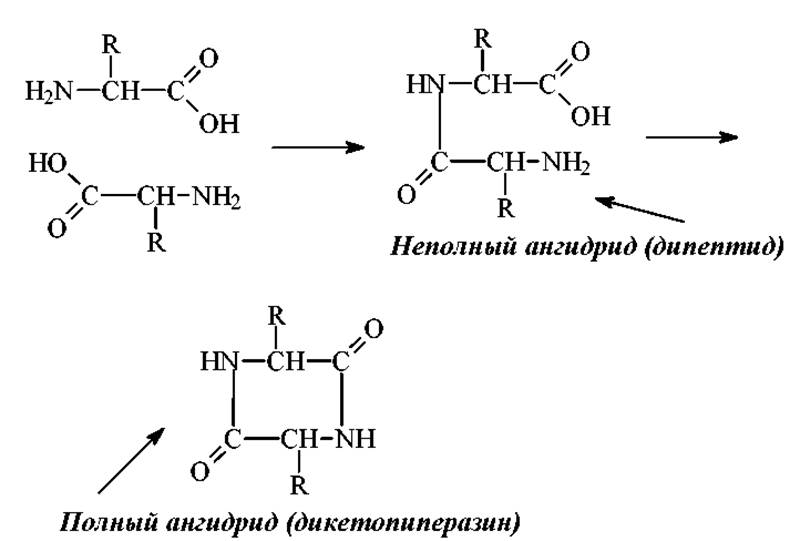
Образование полных и неполных ангидридов аминокислот.
Эта реакция интересна исторически. Образование дикетопиперазинов при гидролизе белков явилось основанием для создания ошибочной дикетопиперазиновой теории строения белка Н. Зелинским в 1914г., которая впоследствии развивалась его учениками В. Садиковым и Н.Гавриловым.