Химия белка. Структура, свойства, методы исследования - Шендрик А.Н. 2022
Аминокислоты
Аминокислоты
Физические и химические свойства аминокислот - Реакции по а-аминогруппе
N-алкилирование. Эта реакция протекает при взаимодействии аминокислот с алкилилгалоидами или диметилсульфатом ((СН3)2)SO4). В последнем случае образуется N-монометил или N,N-диметилпроизводное соответствующей аминокислоты:
HOOC-CH(R)-NH2 + (CH3)2SO4→ HOOC-CH(R)-N(CH3)2 + H2SO4
Вышеназванные реагенты могут замещать также водород в карбоксильной группе или радикале R, но скорость этих реакций существенно меньше. Реакция используется иногда в исследовательских целях для выяснения влияния замещения водорода концевых аминогрупп белка на его биологическую активность.
Арилирование. Представителями этого типа реакций являются: а) известная реакция Сенгера с 2,4-динитрофторбензолом (ДНФБ) и б) реакция Эдмана с фенилизотиоцианатом (ФИТЦ).
Реакция Сенгера протекает в спиртово-щелочной среде при Т = 35-37 С с образованием динитрофенильных производных аминокислот (2,4-динитрофениламинокислота - ДНФ-производное аминокислоты):
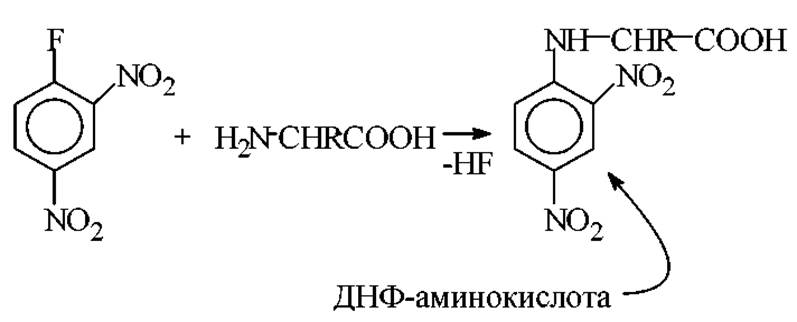
Эту реакцию Ф. Сенгер впервые применил для количественного введения метки в аминогруппы аминокислот и пептидов.
Все аминокислоты присоединяют по a-NH2 группе один радикал ДНФБ. Лизин, гистидин, цистеин, тирозин, присоединяют и второй радикал по ε-NH2-группе, имидазольной, SН-группе и гидроксильной соответственно. Все ДНФ-производные, кроме О-моно-ДНФ-тирозина и S-моно-ДНФ-цистеина окрашены в желтый цвет (λмах = 360 нм). Все они, за исключением ди-ДНФ-лизина, хорошо растворимы в эфире. Последний растворим в бутиловом спирте.
Значимость реакции динитрофенилирования состоит в том, что она является количественной и приводит к образованию желтых кристаллических соединений. Они легко выделяются хроматографически и количественно анализируются методами спектрофотометрии. Кроме того, связь ДНФ - аминокислота не гидролизуется кислотой в продуктах реакции динитрофенилирования. Это позволяет использовать ее для определения N-концевых остатков в белках.
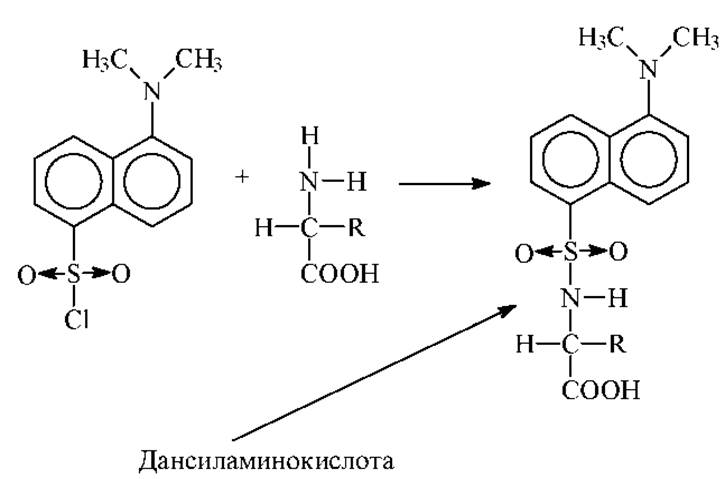
Позже, наряду с ДНФБ, стали применять сходную реакцию между аминогруппой и 1- диметиламинонафтил-5-сульфонилхлоридом (дансилхлорид-ДНС). Образующееся по этой реакции ДНС-производное аминокислоты (дансиламинокислота) обладает интенсивной флуоресценцией. Последняя обусловлена дансильными группами. Это позволяет анализировать следовые количества аминокислот методом флуориметрии.
Реакция Эдмана. Фенилизотиоцианат легко реагирует с аминокислотой в пиридиново-водной среде при рН=8-9 и Т=400С с образованием фенил- тиокарбамоилпроизводных аминокислот. В неводных средах эти производные циклизуются с образованием фенилтиогидантоинов амсинокислот. Уравнения этих реакций мы детально рассмотрим в разделе посвященном методам секвенирования пептидных цепей. Фенилтиогидантоины различных аминокислот легко разделяются хроматографически. После гидролиза щелочью они дают исходную аминокислоту и ФИТЦ.
Ацилирование. Под ацилированием аминокислот понимают широкий круг реакций, которые направлены на введение в аминокислоты остатков карбоновых кислот, арилсульфокислот или сложных эфиров различных кислот.
Примерами ацилирования аминокислот является взаимодействие их с муравьиной кислотой, уксусным ангидридом или газообразным кетеном при нагревании.
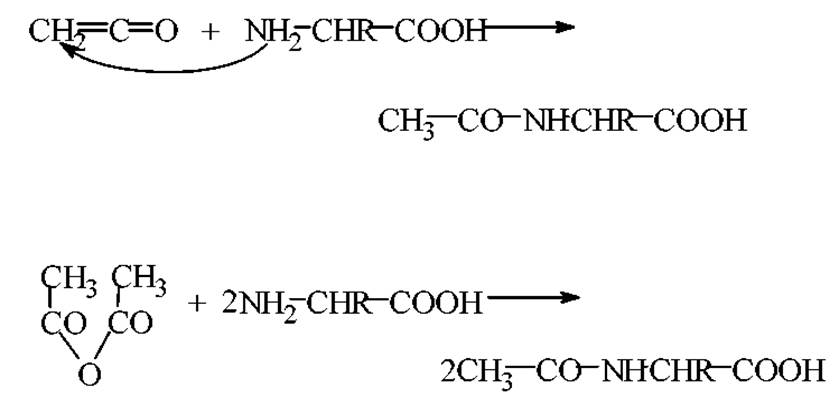
Реакция идет в ледяной уксусной кислоте
Введение остатка органической кислоты часто используют для оценки влияния ацетилирования концевых a-NH2- и ε-NH2-групп лизина на функциональные свойства белка.
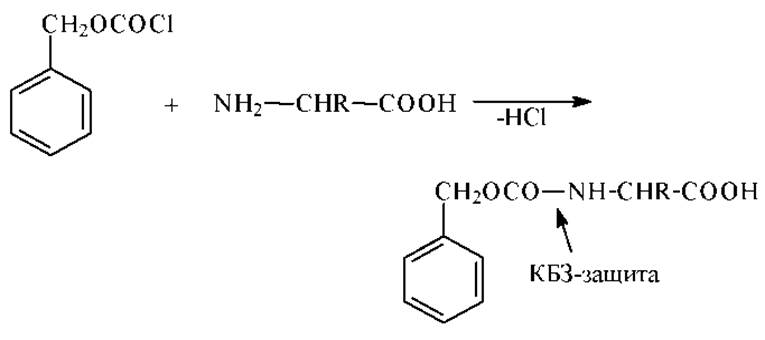
Бензиловые эфиры хлоругольной кислоты. Они оказались полезными для защиты свободной аминогруппы (КБЗ-защита, посредством карбобензоксихлоридов) в процессе синтеза пептидов.
Реакция Ван-Слейка. Аминогруппа аминокислоты реагирует с азотистой кислотой с образованием оксикислоты и выделением газообразного азота:
![]()
Эта реакция является классической для оценки хода гидролиза белков по количеству выделившегося азота, которое легко определяется манометрическим методом.
Достоинства метода Ван-Слейка: реакция протекает быстро (5-10 мин.); реагируют только а-NН2-группы аминокислот и N-концевые группы пептидов. Ни ε-NH2-группа лизина, ни аммиак, отщепляющийся от амидов аспарагиновой и глутаминовой кислот за такое короткое время не успевают прореагировать с азотистой кислотой.
Реакция с формальдегидом (формольное титрование). Эту реакцию впервые предложил Зеренсен. Она находит широкое применение для оценки степени гидролиза белка по количеству освобождающихся карбоксильных групп. Аминогруппы блокируются формальдегидом, а карбоксильные оттитровываются щелочью:
CH2O + H2N-CHR-COOH → CH2=N-CHR-COOH + H2O
CH2=N-CHR-COOH + NaOH → CH2=N-CHR-COONa + H2O
Формальдегид способен также образовывать метиленовые мостики между амино- и какой-либо другой реакционноспособной группой, содержащей подвижные атомы водорода (имидазольной, гуанидиновой, индольной, SH- и -OH группы). Эта реакция широко применяется для получения модифицированных белков.
Переаминирование. При кипячении водных растворов а-аминокислот с а-кетокислотами происходит переход а-аминогруппы от аминокислоты к а-кетокислоте:
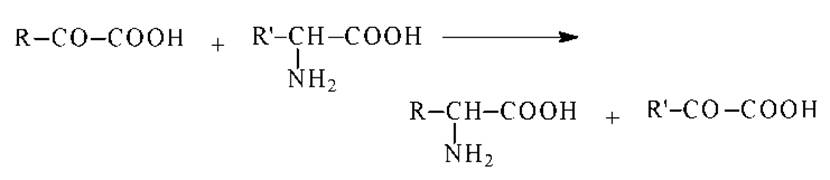
Переаминирование сопровождается часто декарбоксилированием. В присутствии кислорода происходит окислительное дезаминирование и декарбоксилирование:
R-CHNH2-COOH + O2 + H2O → RCHO + NH3 + H2O + CO2
В клетках реакции переаминирования катализируются ферментами - аминотрансферазами.
Образование оснований Шиффа. Аминокислоты взаимодействуют с альдегидами подобно первичным аминам с образованием шиффовых оснований:
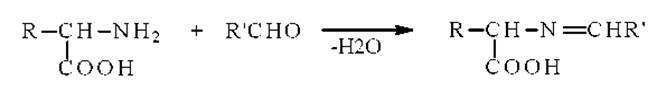
Реакцию проводят в ледяной уксусной кислоте и исследуют полученные основания Шиффа методом электронной спектроскопии или фотоколориметрии.
Реакция с фосгеном. Фосген образует с а-аминокислотами N-карбоксиангидриды (ангидриды Лейкса):
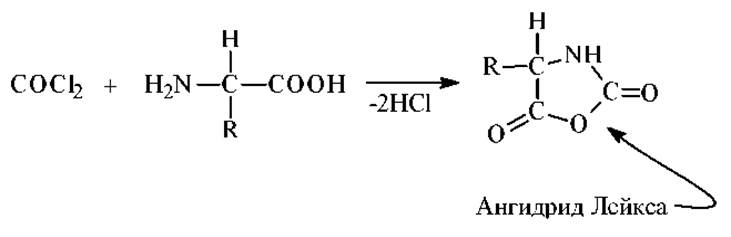
Ангидриды Лейкса взаимодействуют с нуклеофильными реагентами и играют важную роль в качестве промежуточных продуктов синтеза пептидов.