Химия белка. Структура, свойства, методы исследования - Шендрик А.Н. 2022
Структура белков
Структура белков
Химическая фрагментация - Установление аминокислотной последовательности фрагментов белковых молекул
Первым белком, для которого была установлена его аминокислотная последовательность был инсулин. На разработку стратегии этого эксперимента и его реализацию выдающемуся биохимику Ф. Сенгеру (Sanger) потребовалось несколько лет и в 1951 г. он расшифровал первичную структуру инсулина. Фермент состоит из двух цепей (21 и 30 аминокислотных остатка), связанных между собой дисульфидными связями.
В 1958 г Сенгер был удостоен Нобелевской премии за исследование первичной структуры инсулина. В 1980 г ему была присуждена вторая Нобелевская премия за установление последовательности нуклеиновых оснований в полинуклеотидах.

СЕНГЕР (Sanger), Фредерик род. 13 августа 1918 г.
Нобелевская премия по химии, 1958 г.
Нобелевская премия по химии, 1980 г., совместно с Полом Бергом и Уолтером Гилбертом
Английский биохимик Фредерик Сенгер (Сангер) родился в Рендкомбе (графство Глостершир). Его мать была дочерью преуспевающего текстильного магната. Отец работал врачом. С 1932 по 1936 г. будущий ученый обучался в Брайанстонской школе в Блэндфорде (графство Дорсетшир), а в 1936 г. поступил в колледж св. Иоанна Кембриджского университета. Первоначально С. планировал заняться медициной, но его заинтересовала биохимия. “Мне казалось, - писал он много лет спустя, - что это был путь к действительному пониманию живой материи и к разработке более научных основ для решения многих проблем, стоящих перед медициной”.
В 1939 г. в Кембриджском университете С. получил степень бакалавра естественных наук, а в 1943 г. докторскую степень. Он вошел в исследовательскую группу, возглавляемую Э.Ч. Чибналлом, который как раз перед этим сменил Фредерика Хопкинса в должности профессора биохимии Кембриджского университета. В то время Чибналл занимался исследованиями в области химии белков.
В 1902 г. Эмиль Фишер предположил, что белки состоят из аминокислот, связанных между собой пептидными связями. К началу 40-х гг. гипотеза Фишера была широко, хотя и не повсеместно признана. Чибналл предложил С. установить конечную последовательность пептидной цепи химическим путем.
В 1945 г. С. сообщил, что в мягких щелочных условиях динитрофенол может присоединяться к атому азота аминокислоты благодаря связи более сильной, чем пептидная. Следовательно, белок может быть расщеплен на составляющие его аминокислоты с разрушением пептидных связей, а структуру аминокислот можно установить с помощью хроматографии.
Значительная часть исследований, проводимых в лаборатории Чибналла, была связана с инсулином, одним из немногих белков, доступных в то время в чистом виде и в больших количествах. Первоначальное изучение С. инсулина показало, что он содержит две различные N-концевые аминокислоты, т.е. каждая молекула инсулина состоит их двух видов полипептидных цепей. Две молекулы цистеина могут соединяться с образованием цистина посредством дисульфидного мостика между двумя полипептидными цепями, либо между различными участками одной цепи. В 1949 г. С. сообщил, что он открыл способ разрушения этих дисульфидных мостиков и, следовательно, метод разделения двух цепей.
Сенгер и приехавший из Вены Ганс Туппи разработали план установления последовательности чередования аминокислот в каждой полипептидной цепи инсулина, используя для этих целей различные ферменты (протеазы). В 1950 г. Туппи, после установления структуры более длинной из двух инсулиновых цепей, уехал из Кембриджа. Более короткая инсулиновая цепь не так легко поддавалась химическому анализу, и поэтому последовательность чередования в ней аминокислот была полностью установлена только в 1953 г. С. продолжил работу по установлению местоположения дисульфидных мостиков между двумя цепями, и в 1955 г. представил законченную структуру молекулы инсулина. Это была первая белковая молекула, так подробно изученная. Работа С. имела важные последствия для биохимии и зарождающейся науки - молекулярной биологии. Результаты проведенных им исследований окончательно доказали, что белки состоят из аминокислот, соединенных в цепи пептидными связями. С. также доказал, что некоторые ферменты могут разрывать пептидные цепи в заранее установленных местах. Применение этого метода помогло биохимикам определить впоследствии структуру многих других белков.

В 1958 г. С. была присуждена Нобелевская премия по химии “за установление структур белков, особенно инсулина”. В своей Нобелевской лекции С. подчеркнул большое практическое значение проведенной им работы. “Установление структуры инсулина, безусловно, открывает путь к исследованию других белков, - сказал он. - Можно также надеяться, что изучение белков поможет выявить изменения, которые происходят в организме во время болезни, и что наши усилия могут принести человечеству большую практическую пользу”.
Еще до получения Нобелевской премии С. занялся изучением генетики. Отчасти это произошло под влиянием дружбы ученого с Фрэнсисом Криком. Для С. одним из наиболее поразительных фактов, касающихся последовательности чередования отдельных групп в инсулине, было явное отсутствие какого бы то ни было принципа уникального расположения аминокислот. А ведь от этого, казалось бы, случайного порядка зависела важная физиологическая деятельность. С. не понимал, каким образом белок может соединяться именно в такой последовательности, однако было очевидно, что у этого порядка должны быть определенные истоки. В середине 50-х гг. Крик (который вместе с Джеймсом Д. Уотсоном первый описал структуру генетического вещества дезоксирибонуклеиновой кислоты, или ДНК) объяснил сделанные С. открытия, прибегнув к “гипотезе последовательности”, которая заключалась в том, что информацию, определяющую последовательность аминокислот в белке, несут гены. Позднее было установлено, что сами гены представляют собой последовательность звеньев, отдельные группы которых соответствуют определенной аминокислоте.
Нуклеиновые кислоты - ДНК и рибонуклеиновая кислота (РНК) - это цепи связанных нуклеотидов. Записанный в них генетический код для аминокислот определяется последовательностью трех оснований. Процесс строительства белка начинается с того, что соответствующий участок молекулы ДНК, который включает полные указания для сбора соединения, “расстегивает молнию” для связи, соединяющей основания друг с другом. Свободные нуклеотиды (как попало плавающие в клетке) оказываются привязанными вдоль открытой для этого последовательности молекулы ДНК, образуя зеркально отображенную цепь, называемую матричной РНК (мРНК). Законченная цепь мРНК покидает ДНК (которая тогда снова “закрывает молнию”) и продвигается к клеточным структурам, которые называются биросомами, где и будет собираться белок. Участки более короткой цепи формируются мРНК и затем движутся в сторону, с тем чтобы вобрать в себя соответствующие свободные нуклеотиды, которые они затем приносят обратно мРНК для включения в белковую структуру. Эти короткие цепи называются транспортными РНК (тРНК). К тому времени, когда С. приступил к изучению нуклеиновых кислот, об этих процессах мало что было известно, а о нуклеотидных последовательностях не было известно вообще ничего.
Последовательности ДНК и РНК представляют большие трудности для анализа, чем белковые последовательности, поскольку они длиннее. Типичная белковая цепь может содержать до пятидесяти аминокислот, а типичная мРНК содержит сотни нуклеотидов. ДНК даже крошечного вируса состоит из тысяч нуклеотидов. И тем не менее последовательности нуклеиновых кислот легче поддаются раскодированию, чем белковые последовательности, из-за их фундаментального различия: в то время как каждое место в белковой цепи может быть занято любой из 20 различных аминокислот, существует только 4 “претендента” на каждое место в последовательности ДНК - нуклеотиды, сокращенно называемых А, Т, Ц и Г.
В 1958 г. Роберт У. Холли предпринял попытку установить последовательность цепи тРНК. Несмотря на то что длина этих коротких цепей не превышает 100 нуклеотидов, эта работа из-за сложности установления последовательности затянулась до 1965 г. На С. произвела глубокое впечатление работа Холли, но он искал более действенный метод установления последовательности, доступный для применения к цепям мРНК, длина которых нередко достигает нескольких сотен нуклеотидов. В начале 60-х гг. он и его коллеги разработали такую технологию. Применив ферменты, они избирательно расчленили цепи мРНК на более мелкие фрагменты и проследили последовательность в каждой из них. Затем на основании заключений о взаимоотношении между фрагментами была определена последовательность во всей цепи.
Такой подход, однако, требовал массы времени и терпения, и С. решил разработать аналитический метод установления последовательности в ДНК. Он добился этого в 1973 г. Предложенная им процедура заключалась в том, что двойная цепь молекулы ДНК разбивалась на одинарные цепи (называемые стренгами), а затем полученный материал группировался в четыре образца. Каждый образец начинают восстанавливать до первоначальной последовательности двойной цепи, исходя из шаблона одинарной цепи. Однако исследователи останавливают процесс восстановления на разных нуклеотидах для каждого образца либо путем ограничения концентрации того или иного свободного нуклеотида, либо помещая в цепь определенный нуклеотид с таким химикатом, который предотвращает дальнейший синтез. В результате этого реконструированные цепи представляют собой образцы различной длины, но каждая заканчивается одинаковым нуклеотидом. Затем эти четыре образца одновременно пропускают через фильтрующий материал - сверхтонкий акриламидным гелем, который разделяет эти цепи в соответствии с их длиной, поскольку более короткие цепи проходят через гель быстрее. И тогда нуклеотидная последовательность первоначальной цепи ДНК может быть прочитана прямо с геля путем сравнения следов, оставленных образцами.
В то время как С. м его коллеги работали над этим методом (названным дидекоксидным методом по типу используемого при этом ограничивающего химиката), американские ученые Уолтер Гилберт и Аллан Мэксам разрабатывали другую процедуру установления нуклеотидных последовательностей. В соответствии с их методом фрагменты цепи ДНК различной длины получают, разрывая цепь на специфических основаниях. Этот подход напоминает метод, который применил С. для установления последовательностей в белковых цепях и цепях РНК. Как технология С., так и технология Гилберта стали важнейшим инструментом генной инженерии, хотя метод С. несколько более эффективен при работе с очень длинными последовательностями. Еще в 1978 г. С. и его коллеги продемонстрировали действенность дидезоксидного метода, установив последовательность 5375 оснований в цепи ДНК бактериального вируса. Это был первый случай такой подробной расшифровки цепи ДНК.
В 1980 г. С. и Гилберту была присуждена половина Нобелевской премии по химии “за вклад в установлении основных последовательностей в нуклеиновых кислотах”. Другая половина премии была присуждена Полу Бергу. Эти трое ученых, сказал в своей вступительной речи от имени Шведской королевской академии наук Б.Г. Мальстрем, “сделали возможным проникновение в еще большие глубины в нашем понимании взаимосвязи между химической структурой и биохимической функцией генетического материала”.
В 1983 г. С. вышел в отставку с занимаемого им поста в Медицинском научно-исследовательском совете. Скромный, склонный к уединению человек, он живет в Кембридже со своей женой Маргарет Джоан Хоув. Брак с ней был зарегистрирован в 1940 г. У супругов два сына и дочь.
С. удостоен многочисленных наград. Среди них: медаль Кордей-Моргана и премия, присужденные ему Британским химическим обществом (1951), премия Альфреда Бензонса Фонда Альфреда Бензонса (1966), Королевская медаль Лондонского королевского общества (1969), ежегодная награда Гарднеровского фонда (1971 и 1979), памятная медаль Хэнбери Фармацевтического общества Великобритании (1976), медаль Копли Лондонского королевского общества (1977) и премия Альберта Ласкера за фундаментальные медицинские исследования (1979). С. - почетный член Американского общества биохимиков и американской Национальной академии наук, обладатель почетных степеней университетов Лестера и Страсбурга, а также Кембриджа и Оксфорда.
Источник информации: Лауреаты Нобелевской премии: Энциклопедия: Пер. с англ.- М.: Прогресс, 1992.
К настоящему времени количество белков, для которых установлена аминокислотная последовательность, исчисляется тысячами и их число очень быстро растет. Одним из выдающихся достижений в этой области было определение аминокислотной последовательности молекулы антитела гамма-глобулиновой фракции крови, которая включает 1320 аминокислот. В настоящее время все полученные и получаемые данные о пространственной структуре белков заносятся в банк данных (см. в сети "Internet": http://nist.rcsb.org/pdb/). По мере накопления информации этот банк предполагается использовать в будущем для предсказания форм белковых молекул и их функций исходя из аминокислотной последовательности.
В основе методов установления аминокислотной последовательности пептидов лежит реакция Эдмана (1950-1956г) - это деградация полипептидной цепи со стороны N-концевой аминокислоты с помощью ФИТЦ.
Каждый цикл деградации включает три стадии.
1. Образование фенилтиокарбамоилпептида (ФТК-пептида)
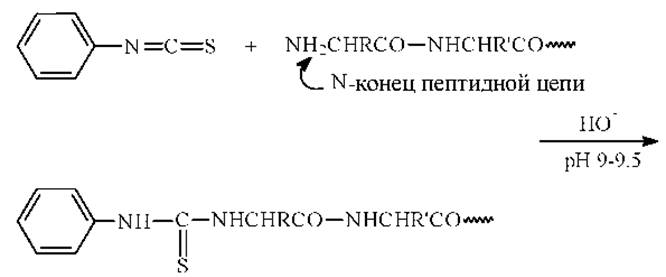
2. Отщепление N-концевой аминоксилоты в форме анилинотиазолинона:
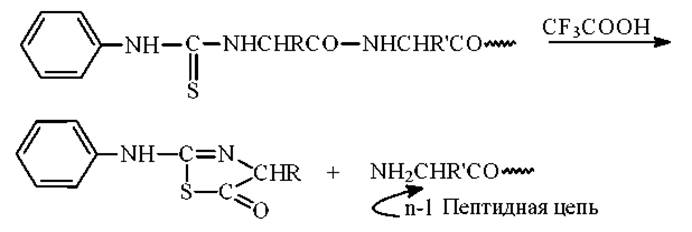
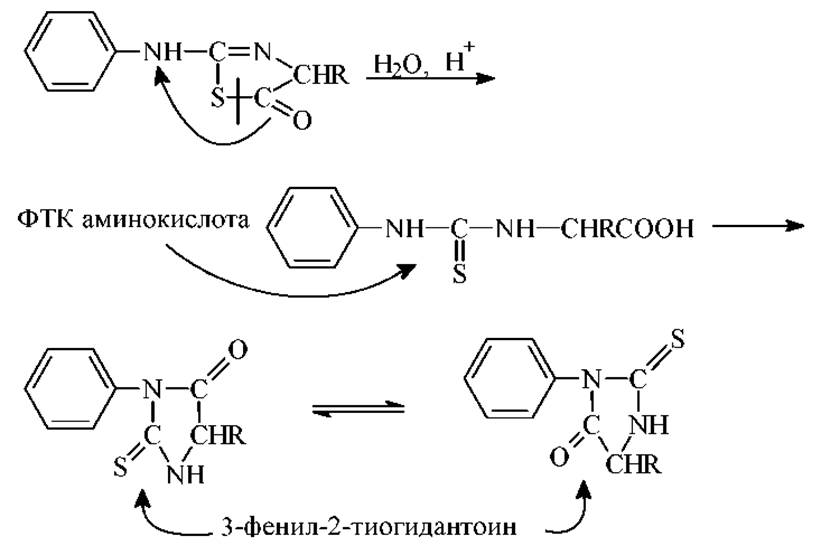
3. Изомеризация тиазолинона в 3-фенил-2-тиогидантоин (ФТГ) и его идентификация. Эта стадия идет через образование фенилтиокарбамоиламинокислоты (ФТК - аминокислота):
Первая стадия - присоединение ФИТЦ к непротонированной а-аминогруппе концевой аминокислоты. (рН=9-9.5, легко летучие буферные системы). В качестве оснований можно использовать третичные или гетероциклические амины (триэтиламин, диметилаллиламин, пиридин).
Побочные реакции.
> Окислительное десульфирование ФТК-группы под действием кислорода воздуха (все стадии проводят, поэтому, в среде инертного газа).
> Гидролиз ФИТЦ с образованием дифенилтиомочевины и анилина и образование побочных продуктов, которые затруднят идентификацию фенилтиогидантоинов аминокислот. Поэтому по завершению первой стадии экстрагируют бензолом остаток ФИТЦ и его побочных продуктов.
Вторая стадия - отщепление тиазолинона. Эта реакция идет легко и, как правило, без образования побочных продуктов. Исключение - концевые остатки глутамина могут превращаться в остатки пироглутаминовой кислоты, блокируя тем самым дальнейшую деградацию пептидной цепи:
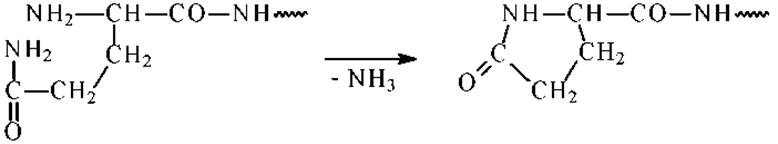
Вторую стадию проводят в присутствии безводной трифторуксусной кислоты.
Третья стадия - изомеризация. Протекает в два этапа. Вначале проходит быстрый гидролиз с превращением тиазолинона в ФТК-аминокислоту и дальнейшая циклизация в фенилтиогидантоин (ФТГ). Эта реакция протекает в условиях: 1н НСl, 80∘С, 10 мин. Некоторые ФТГ в этих условиях частично разрушаются. Так например, ФТГ серина и треонина подвергаются дегидратации.
На втором этапе добавляют бутилацетат и разделяют фазы. Органическая фаза содержит ФТГ, водная остаточный пептид с длинной цепи меньшей на единицу. Водную фазу отделяют и направляют на следующий цикл деградации.
В органической фазе проводят идентификацию ФТГ. Для этой цели используют хроматографию на бумаге или в тонком слое, жидкостную, газожидкостную хроматографию и др. методы физико-химического анализа. ФТГ можно гидролизовать с помощью НІ до свободной аминокислоты и идентифицировать ее.
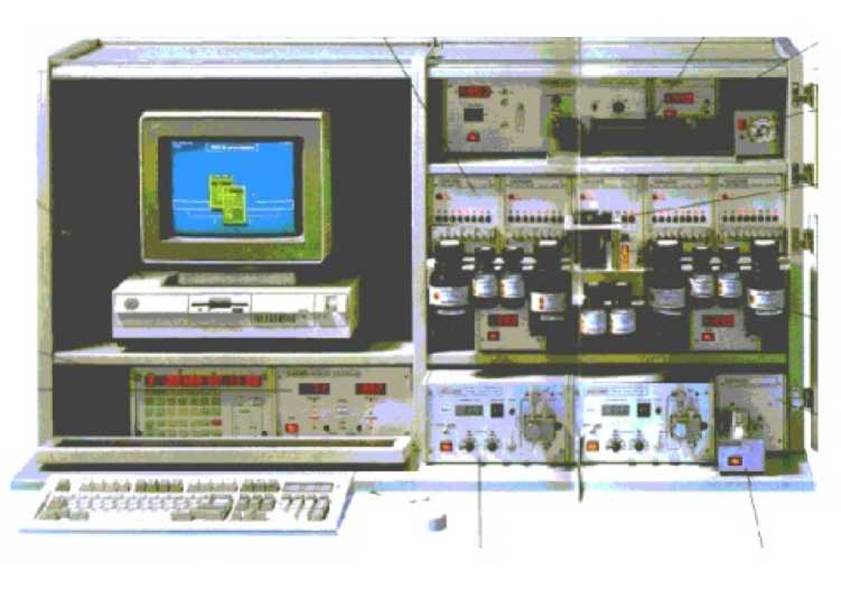
В 1967 г. Эдман и Бэгг разработали прибор (секвенатор) для установления аминокислотной последовательности коротких пептидов и их фрагментов в автоматическом режиме. В секвенаторе все реакции проводят в цилиндрическом стеклянном стакане, который вращается вокруг собственной оси с постоянной скоростью в атмосфере инертного газа (см. рис.).
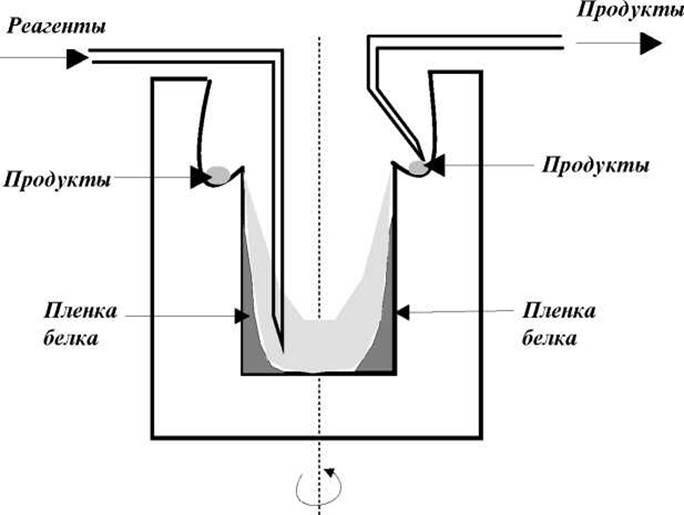
Образец белка наносится в виде пленки на стенки стакана, а реагенты в растворителе подаются на дно. За счет центробежной силы раствор при вращении стакана поднимается по его стенкам, омывая белок и собираясь в специальной канавке. Из этой канавки растворенные продукты удаляются из стакана посредством специальной отводной трубки. Такой способ проведения реакции обеспечивает большую площадь соприкосновения белка с реагентами, высокую скорость и непрерывность процесса секвенирования.
В настоящее время приборостроительная промышленность ряда развитых стран мира производит автоматические секвенаторы, работающие по предложенному Эдманом и Бэггом принципу вращающегося стакана. Разделение и анализ образующихся фенилтиогидантоинов выполняется в них с помощью метода высокоэффективной жидкостной хроматографии. Внешний вид одного из таких секвенаторов представлен на рисунке ниже: