Химия белка. Структура, свойства, методы исследования - Шендрик А.Н. 2022
Структура белков
Структура белков
Химическая фрагментация - Механизмы реакций химической фрагментации
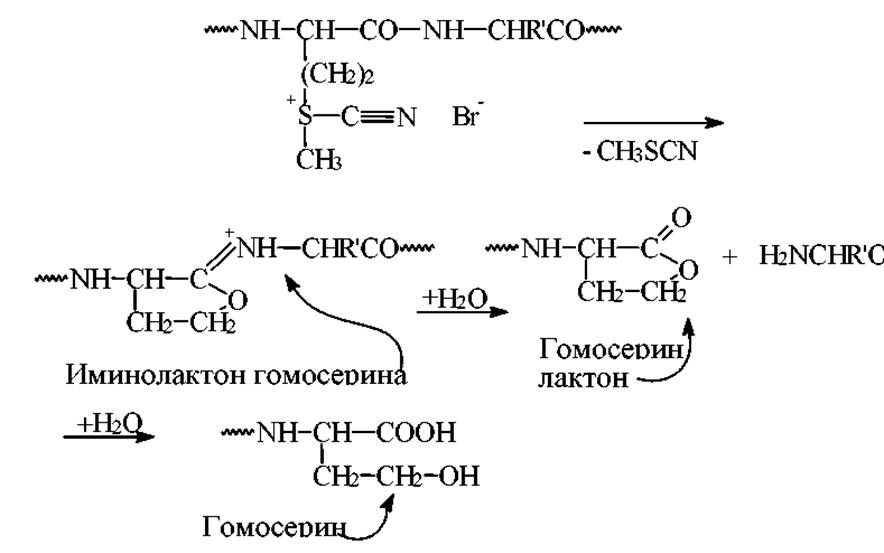
Расщепление по метионинину бромцианом основано на взаимодействии бромциана с тиоэфирной группой метионина с образованием циансульфониевой соли. Процесс дальнейших превращений этой соли представлен на схеме.
Впервые бромциан был применен при исследованиях рибонуклеазы. Одной из наиболее длинных белковых цепей, которые удалось расщепить с помощью бромциана является ß-галактозидаза из E.Coli (1021 аминокислотных остатков).
Условия проведения реакции. Комнатная температура, 15-30 часов, среда - 70% НСООН, 100 кратный избыток бромциана. Связи мет-Х расщепляются на 90-100%. По избирательности эта реакция уникальна. Для расщепления очень устойчивых фрагментов Мет-Сер, Мет-Тир реакцию лучше проводить в водной трифторуксусной кислоте. Во всех полученных фрагментах С-концевые остатки представляют собой гомосеринлактон.
Осложнения: в присутствии бромциана идет окисление цистеина до цистина и дальше до цистеиновой кислоты. Избыток бромциана бромирует остатки тирозина и расщепляет пептидные цепи по остаткам триптофана.
Замена 70% муравьиной кислоты более сильной гексафтормасляной и увеличение избытка бромциана (до 10000 моль/моль белка) повышает выход продуктов гидролиза пептидных цепей по триптофану.
Расщепление по триптофану. Методы селективного расщепление пептидных связей по остаткам триптофана основаны на высокой реакционной способности индольного ядра. Таких методов несколько.
1. По триптофану N-бромсукцинимидом.
Условия: комнатная температура, 2 часа, рН = 4.0, 2 - 3 кратный избыток NBS. Пептиды расщепляются на 50 - 90%, белки - на 10 -60%.
2. В последнее время для расщепления пептидов и белков по остатку триптофана применяют главным образом 2-(2-нитрофенилсульфенил)3-бромо-3- метилиндоленил (BNPS-скатол). Этот реагент получают бромированием 2-(2-нитрофенил-сульфенил)-3-метилиндола (I) N-бромсуцинимидом в ледяной уксусной кислоте:
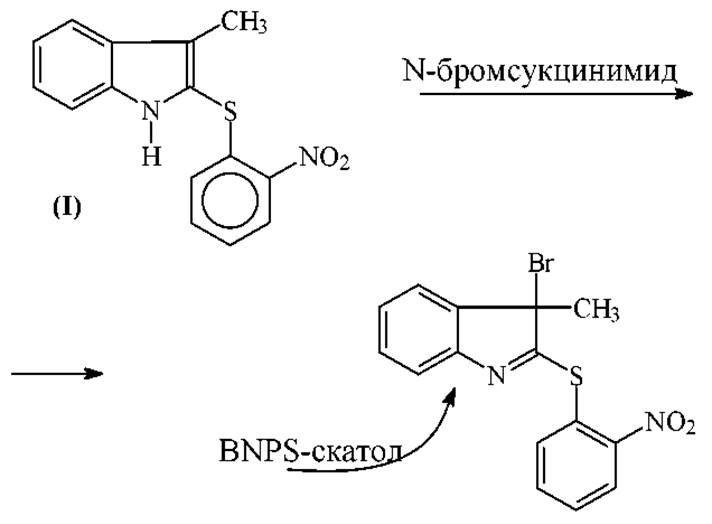
BNPS-скатол, по сравнению с N-бромсукцинимидом, действует более избирательно. Выполнены многочисленные исследования по применению BNPS-скатола в химии белка. Выход продуктов избирательного расщепления по триптофану колеблется в пределах 40-80%. Не исключено, что выход определяется качеством реагента.
BNPS-скатол разлагается при комнатной температуре под действием света с выделением брома. Однако, хорошо очищенные кристаллические препараты (бледно-желтые звездочки из лигроина) хранятся в герметичной упаковке при 20∘С достаточно долго.
3. По триптофану в системе DMSO-галогенводородные кислоты
Расщепление по триптофану смесью DMSO-HBr проводят в уксусной кислоте. По выходу продуктов реакции этот метод сопоставим с расщеплением BNPS-скатолом и предпочтительнее его по доступности реагентов и простоте реализации.
Механизм реакции - окислительное галогенирование индольного ядра триптофана. Галогенирование ядра осуществляется промежуточными продуктами реакции между DMSO и HGal (дигалогенид сульфида (I), галогенид галогенсульфония (II), свободный галоген)
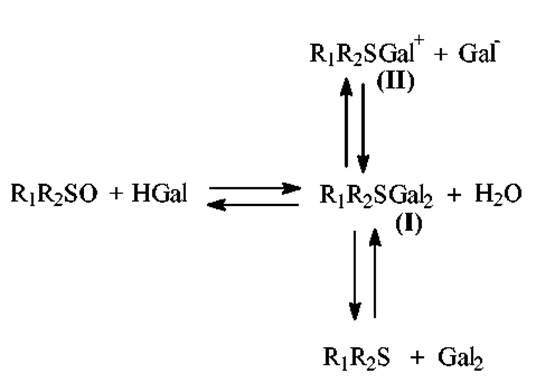
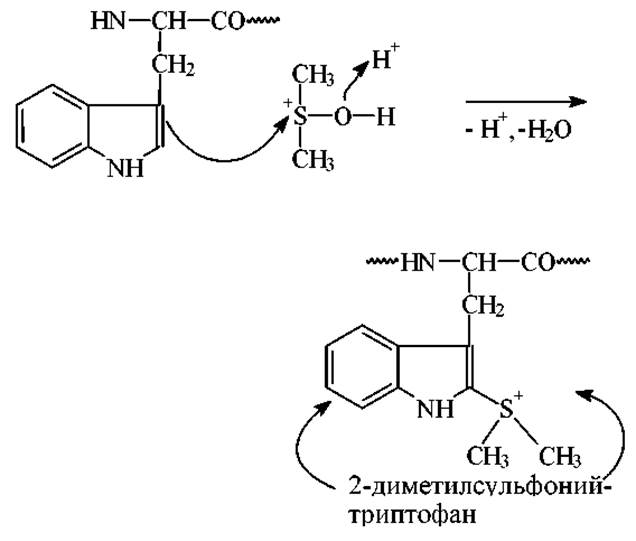
Непосредственное взаимодействие триптофансодержащих пептидов с DMSO-HBr приводит к образованию промежуточного продукта - 2-диметилсульфонийтриптофана:
4. Расщепление по Три о-иодбензойной кислотой проводят в 80% уксусной кислоте с добавками 4 М солянокислого гуанидина. Согласно последним данным метод не очень специфичен. Побочно идет расщепление по остатку тирозина. Если из реакционной смеси удалить галоген расщепление пептидной связи не идет. Предполагается, что механизм процесса аналогичен другим реакциям с использованием галогенирующих агентов (в том числе N-бромсукцинимида), а окислительное галогенирование - есть свойство системы: о-иодбензойная к-та : 4 М солянокислый гуанидин. Уменьшить вероятность расщепления по тирозину удается добавками п-крезола. В этом случае метод применим для избирательного расщепления по триптофану.
5. Известны другие методы расщепления по триптофану. Среди них - расщепление активным иодом. Последний генерируют в системе: пероксид водорода - соли HJ - лактопероксидаза (или пероксидаза хрена). Выход 30-40%. С аналогичным выходом идет расщепление под действием иодирующих агентов J2, J3-, JCl, смеси: (хлорамин Т)/KJ.
Расщепление по карбоксильной группе триптофана в кислой среде можно осуществить под действием N-хлорсукцинимида. Остальные связи не затрагиваются, в том числе и по тирозину или гистидину. Выходы и скорости реакций меньше, чем с N-бромсукцинимидом.
Избирательно, пептидные связи триптофана в белках и пептидах, можно расщепить с помощью 2,4,6-трибромо-4-метилциклогексадиенона (трибромкрезола):
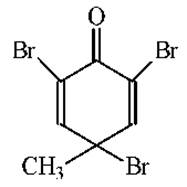
Пептидные связи тирозина и гистидина не затрагиваются. Однако, тирозин превращается в 3,5-дибромпроизводное, цистеин окисляется до цистеиновой кислоты, метионин - в метионин-S-оксид и идет модификация гистидина.
Расщепление по тирозину. При отсутствии в молекуле белка остатков триптофана избирательное расщепление по тирозину можно осуществить с помощью N-бромсукцинимида.
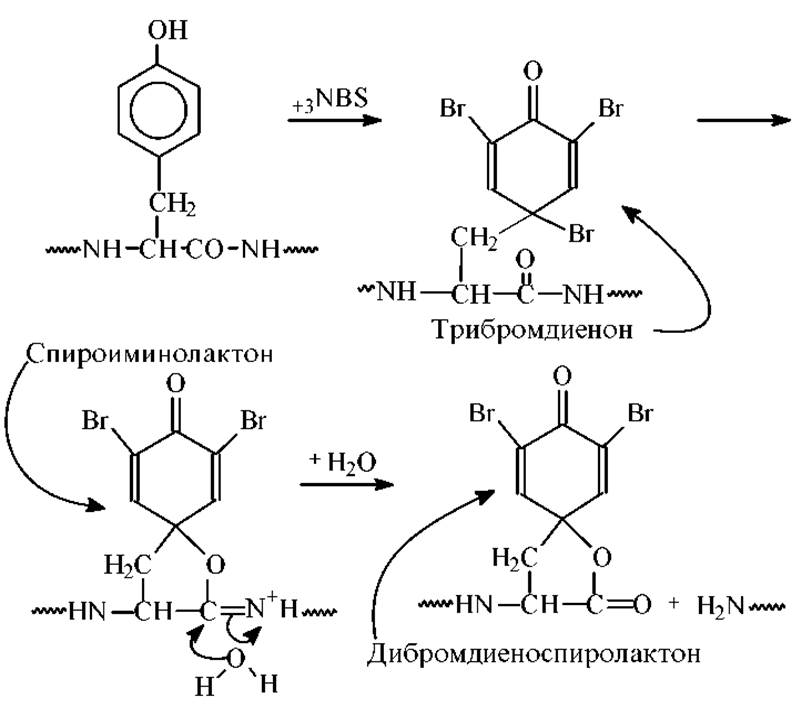
Диеноспиролактон - сильный хромофор с λmах = 260 нм (s = 10000-11000).
Метод часто применяется для исследования гистонов, которые не содержат остатков триптофана. Выход, обычно неколичественный, но увеличивается при увеличении избытка реагента.
Условия проведения реакции: 20∘С, 6 часов, 50% СН3СООН, глубина 3065%. В присутствии триптофана расщепление по тирозину идет только при большом избутке NBS.
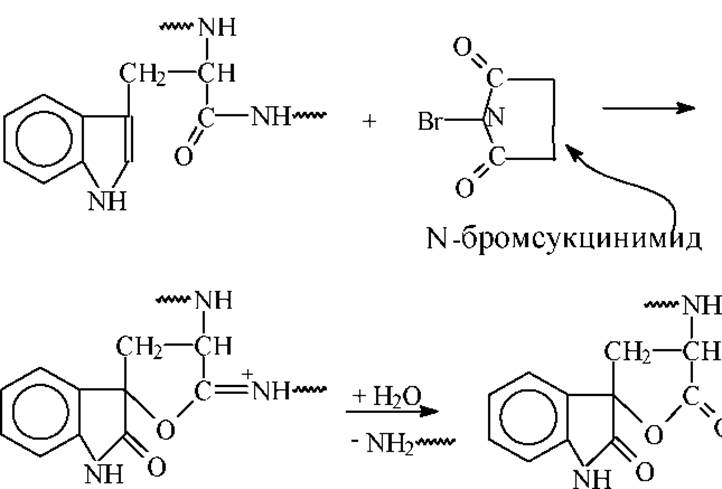
Расщепление по остатку цистеина. В основе метода избирательного расщепления пептидной связи по аминогруппе цистеина лежит превращение SH-групп в тиоциановые группировки. Впервые расщепление по цистеину под действием цианидов было выполнено в 1964-65гг. Механизм реакции представлен ниже на схеме.
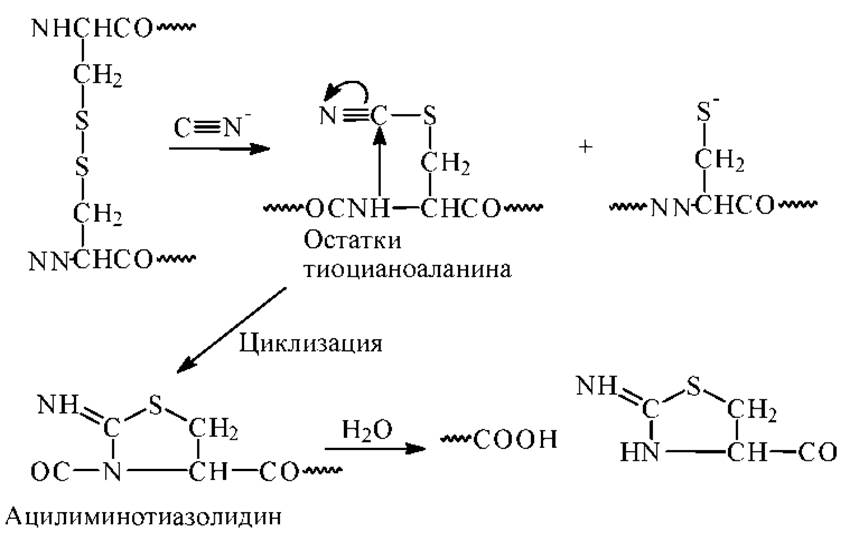
В реакции образуется вначале остатки тиоцианоаланина, которые циклизуются в ацилиминотиазолидин. Затем идет быстрый гидролиз пептидной связи. Расщепление дисульфидных связей цианидами приводит к частичному и случайному образованию тиоцианогрупп.
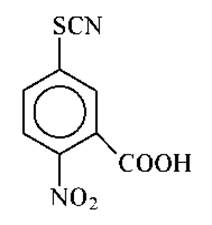
Предложен метод прямого и количественного превращения SH-групп в соответствующие тиоцианопроизводные с помощью 2-нитро-5-тиоцианобензойной кислоты:
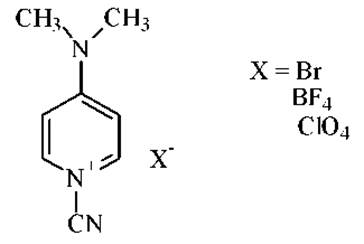
Показано также, что активным цианирующим агентом SH-групп в белках является соли 1-циано-4-диметиламино-пиридиния:
Другие химические методы расщепления пептидных связей
Расщепление по связи Асн-Гли гидроксиламином основано на способности боковой цепи остатка аспарагина циклизоваться с образованием замещенного сукцинимида. Последний подвергается нуклеофильной атаке со стороны гидроксиламина с расщеплением пептидной связи. Повышенная лабильность связи Асн-Гли в этой реакции обусловлена, видимо, отсутствием стерических препятствий циклизации.
Краткая схема механизма реакции выглядит следующим образом:
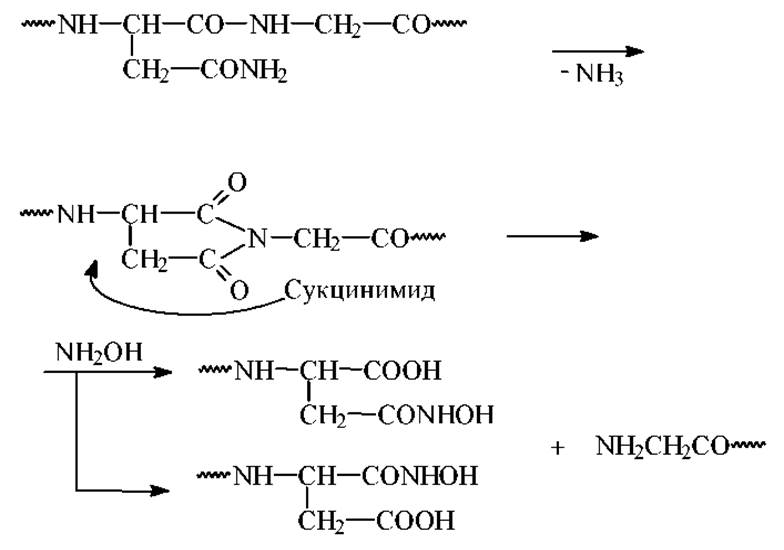
Связь Гли-Гли не расщепляется. Условия 20∘С, 4 часа, рН=9, 6М гуанидин •НСl + 2% NH2OH•HCl
Расщепление по связи Асп-Про. Эта связь наиболее лабильна в условиях кислотного гидролиза и легко расщепляется уже в мягких условиях: 10% CH3COOH + пиридин, рН — 2.5, 7 М солянокислый гуанидин, 40 С, 4 суток.
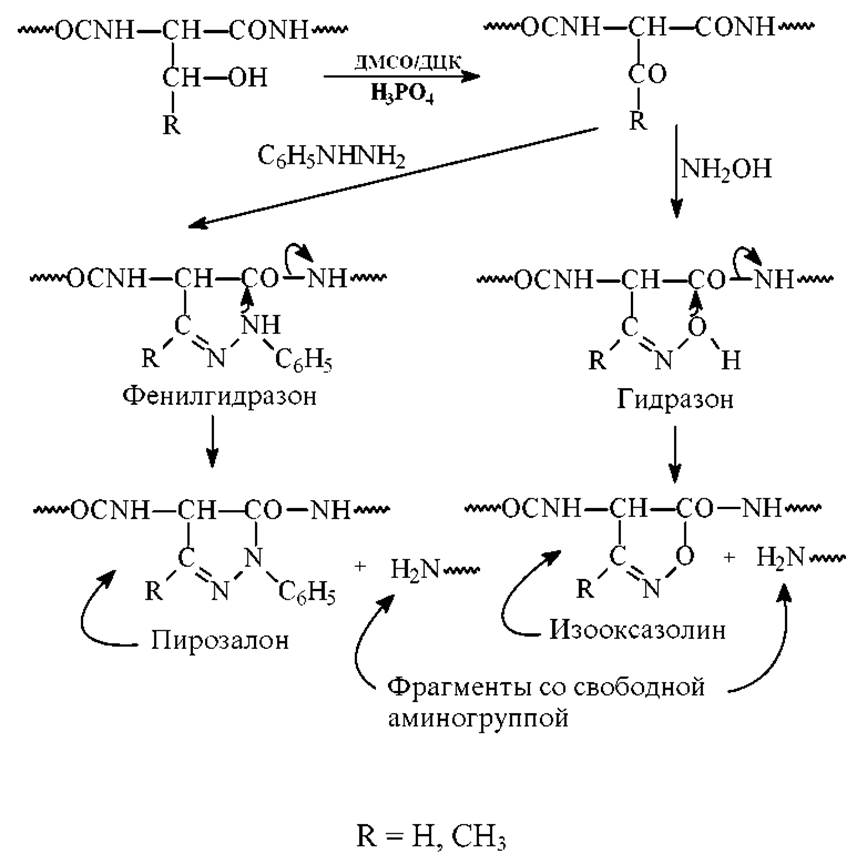
Известен метод расщепления пептидных связей серина и треонина, основанный на предварительном окислении гидроксильной группы дициклогексилкарбодиимидом (ДЦК) в присутствии фосфорной кислоты в среде ДМСО и последующей реакции с фенилгидразином. Промежуточный продукт реакции фенилгидразон циклизуется в пиразол с одновременным отщеплением фрагмента со свободной NH-концевой аминогруппой.
Возможен и другой вариант, когда под действием гидроксиламина образуется промежуточный гидразон. Он циклизуется в изооксазолин с образованием фрагмента пептидной цепи со свободной аминогруппой. Схема этих реакций: