Химия белка. Структура, свойства, методы исследования - Шендрик А.Н. 2022
Структура белков
Пространственная структура белков
Вторичная структура белков - Спиральные структуры
Специфический тип ориентации пептидной цепи в пространстве, является результатом того или иного вида свободного вращения вокруг связей, соединяющих а-углеродные атомы. В природных пептидах и белках различают три основных типа вторичной структуры:
> спираль;
> складчатый лист;
> статистический клубок.
Спиралевидная и плоская формы представляют собой упорядоченные структуры, статистическая - неупорядоченную.
При упорядоченном расположении белковой цепи проявляется отчетливо различимая ориентация, присущая цепи с одинаковыми углами поворота φ и ψ. В пептидных цепях встречаются лево- и правозакрученные спирали (левая и правая спирали), см рис.2.1
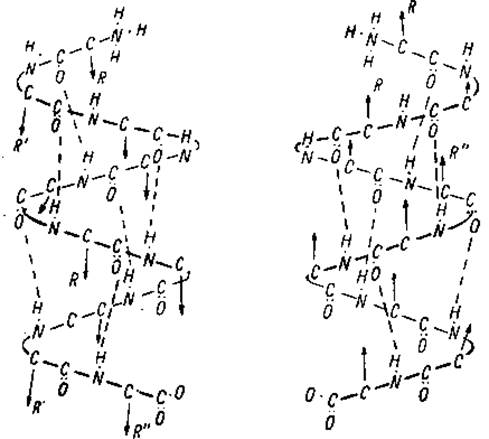
Рис. 2.1 Фрагменты пептидных цепей с левой и правой спиралями. R-остатки расположены перпендикулярно к плоскости рисунка.
Для пептидных цепей, состоящих из L- аминокислот, энергетически более выгодной является правая спираль, а для D-аминокислотных остатков предпочтительнее левая спираль. Наличие спиралевидных структур в белковых цепях впервые доказали Полинг и Кори в 1951г. (см. рис.2.2).
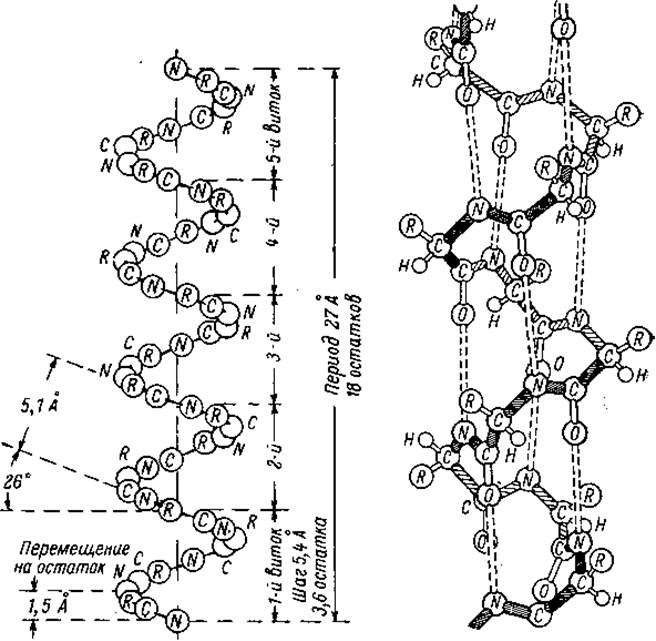
Рис. 2.2 Модель а-спирали по Полингу-Кори
В 1954г Полингу за развитие теории химической связи и приложение ее к структуре белка была присуждена Нобелевская премия. В 1962 году он удостоен Нобелевской премии мира.
ПОЛИНГ (Pauling), Лайнус К.
28 февраля 1901 г. - 19 августа 1994 г.
Нобелевская премия по химии, 1954 г.
Нобелевская премия мира, 1962 г.
Американский химик Лайнус Карл Полинг (Паулинг) родился в Портленде (штат Орегон), в семье фармацевта. Полинг-старший умер, когда его сыну исполнилось 9 лет. П. с детства увлекался наукой. Вначале он собирал насекомых и минералы. В 13-летнем возрасте один из друзей П. приобщил его к химии, и будущий ученый начал ставить опыты. Делал он это дома, а посуду для опытов брал у матери на кухне. П. посещал Вашингтонскую среднюю школу в Портленде, но не получил аттестата зрелости. Тем не менее он записался в Орегонский государственный сельскохозяйственный колледж (позже он стал Орегонским государственным университетом) в Корваллисе, где изучал главным образом химическую технологию, химию и физику. Чтобы поддержать материально себя и мать, он подрабатывал мытьем посуды и сортировкой бумаги. Когда П. учился на предпоследнем курсе, его как на редкость одаренного студента приняли на работу ассистентом на кафедру количественного анализа. На последнем курсе он стал ассистентом по химии, механике и материалам. Получив в 1922 г. степень бакалавра естественных наук в области химической технологии, П. приступил к подготовке докторской диссертации по химии в Калифорнийском технологическом институте в Пасадене.

П. был первым в Калифорнийском технологическом институте, кто по окончании этого высшего учебного заведения сразу стал работать ассистентом, а затем преподавателем на кафедре химии. В 1925 г. ему была присуждена докторская степень по химии summa cum laude (с наивысшей похвалой. - лат.). В течение последующих двух лет он работал исследователем и был членом Национального научно-исследовательского совета при Калифорнийском технологическом институте. В 1927 г. П. получил звание ассистент-профессора, в 1929 - адъюнкт-профессора, а в 1931 г. - профессора химии.
Работая все эти годы исследователем, П. стал специалистом по рентгеновской кристаллографии. Применяя этот метод, он изучал природу химических связей в бензоле и других ароматических соединениях. Стипендия Гуггенхейма позволила ему провести учебный 1926/1927 г. за изучением квантовой механики у Арнольда Зоммерфельда в Мюнхене, Эрвина Шредингера в Цюрихе и у Нильса Бора в Копенгагене.
В 1928 г. (в возрасте 27 лет) П. выдвинул свою теорию резонанса, или гибридизации, химических связей в ароматических соединениях, которая основывалась на почерпнутой из квантовой механики концепции электронных орбиталей. В более старой модели бензола, которая время от времени еще использовалась для удобства, три из шести химических связей (связывающих электронные пары) между смежными атомами углерода были одинарными связями, а остальные три - двойными. Одинарные и двойные связи чередовались в бензольном кольце. Таким образом, бензол мог обладать двумя возможными структурами в зависимости от того, какие связи были одинарными, а какие - двойными. Известно было, однако, что двойные связи короче, чем одинарные, а дифракция рентгеновских лучей показывала, что все связи в молекуле имеют равную длину. Теория резонанса утверждала, что все связи между атомами углерода в бензольном кольце были промежуточными по характеру между одинарными и двойными связями. Согласно модели П., бензольные кольца можно рассматривать как гибриды их возможных структур. Эта концепция оказалась чрезвычайно полезной для предсказания свойств ароматических соединений.
В течение последующих нескольких лет П. продолжал изучать физико-химические свойства молекул, особенно связанных с резонансом. В 1934 г. он обратил внимание на биохимию, в частности на биохимию белков. Совместно с А.Е. Мирски он сформулировал теорию строения и функции белка, вместе с Ч.Д. Корвеллом изучал влияние оксигенирования (насыщения кислородом) на магнитные свойства гемоглобина.
Когда в 1936 г. умер Арту Нойес, П. был назначен деканом факультета химии и химической технологии и директором химических лабораторий Гейтса и Креллина в Калифорнийском технологическом институте. Находясь на этих административных должностях, он положил начало изучению атомной и молекулярной структуры белков и аминокислот с применением рентгеновской кристаллографии.
В 1942 г. П. и его коллегам, получив первые искусственные антитела, удалось изменить химическую структуру некоторых содержащихся в крови белков, известных как глобулины. П. выдвинул верный постулат, что трехмерные структуры антигена и его антитела комплементарны и, таким образом, “несут ответственность” за образование комплекса антиген - антитело. В 1947 г. он и Джордж У. Бидл получили субсидию для проведения рассчитанных на пять лет исследований механизма, с помощью которого вирус полиомиелита разрушает нервные клетки.
Работа П. над серповидноклеточной анемией началась в 1949 г., когда он узнал, что красные кровяные клетки больных этой наследственной болезнью становятся серповидными только в венозной крови, где низок уровень содержания кислорода. На основе знания химии гемоглобина П. немедленно выдвинул предположение, что серповидная форма красных клеток вызывается генетическим дефектом в глубине клеточного гемоглобина. Это предположение - наглядное свидетельство удивительной научной интуиции, столь характерной для П. Три года спустя ученому удалось доказать, что нормальный гемоглобин и гемоглобин, взятый у больных серповидноклеточной анемией, можно различать с помощью электрофореза. Сделанное открытие подтвердило убеждение П. в том, что причина аномалии кроется в белковой части молекулы.
В 1951 г. П. и Р.Б. Кори опубликовали первое законченное описание молекулярной структуры белков. Это был результат исследований, длившихся долгих 14 лет. Применяя методы рентгеновской кристаллографии для анализа белков в волосах, шерсти, мускулах, ногтях и других биологических тканях, они обнаружили, что цепи аминокислот в белке закручены одна вокруг другой таким образом, что образуют спираль. Это описание трехмерной структуры белков ознаменовало крупный прогресс в биохимии.
Но не все научные начинания П. оказывались успешными. В начале 50-х гг. он сосредоточил свое внимание на дезоксирибонуклеиновой кислоте (ДНК) - биологической молекуле, которая содержит генетический код. В 1953 г., когда ученые в разных странах мира пытались установить структуру ДНК, П. опубликовал статью, в которой описывал эту структуру как тройную спираль, что не соответствует действительности. Несколько месяцев спустя Фрэнсис Крик и Джеймс Д. Уотсон опубликовали свою ставшую знаменитой статью, в которой молекула ДНК описывалась как двойная спираль.
В 1954 г. П. была присуждена Нобелевская премия по химии “за исследование природы химической связи и ее применение для определения структуры соединений”. В своей Нобелевской лекции П. предсказал, что будущие химики станут “опираться на новую структурную химию, в т. ч. на точно определенные геометрические взаимоотношения между атомами в молекулах и строгое применение новых структуральных принципов, и что благодаря этой технологии будет достигнут значительный прогресс в решении проблем биологии и медицины с помощью химических методов”.
Несмотря на то что в юные годы, которые пришлись на первую мировую войну, П. был пацифистом, во время второй мировой войны ученый занимал официальный пост члена Национальной научно-исследовательской комиссии по обороне и работал над созданием нового ракетного топлива и поисками новых источников кислорода для подводных лодок и самолетов. В качестве сотрудника Управления научных исследований и развития он внес значительный вклад в разработку плазмозаменителей для переливания крови и для военных нужд. Однако вскоре после того, как США сбросили атомные бомбы на японские города Хиросиму и Нагасаки, П. начал кампанию против нового вида оружия и в 1945...1946 гг., являясь членом Комиссии по национальной безопасности, читал лекции об опасностях ядерной войны.
В 1946 г. П. стал одним из основателей Чрезвычайного комитета ученых-атомщиков, учрежденного Альбертом Эйнштейном и 7 другими прославленными учеными с тем, чтобы добиваться запрещения испытаний ядерного оружия в атмосфере. Четыре года спустя гонка ядерных вооружений уже набрала скорость и П. выступил против решения своего правительства о создании водородной бомбы, призвав положить конец всем испытаниям ядерного оружия в атмосфере. В начале 50-х гг., когда и США, и СССР провели испытания водородных бомб и уровень радиоактивности в атмосфере повысился, П. использовал свой немалый талант оратора, чтобы обнародовать возможные биологические и генетические последствия выпадения радиоактивных осадков. Озабоченность ученого потенциальной генетической опасностью отчасти объяснялась проводимыми им исследованиями молекулярных основ наследственных заболеваний. П. и 52 других нобелевских лауреата подписали в 1955 г. Майнаускую декларацию, призывавшую положить конец гонке вооружений.
Когда в 1957 г. П. составил проект воззвания, в котором содержалось требование прекратить ядерные испытания, его подписало более 11 тыс. ученых из 49 стран мира, и среди них свыше 2 тыс. американцев. В январе 1958 г. П. представил этот документ Дагу Хаммаршёльду, который был тогда генеральным секретарем ООН. Предпринятые П. усилия внесли свой вклад в учреждение Пагуошского движения за научное сотрудничество и международную безопасность, первая конференция сторонников которого состоялась в 1957 г. в Пагуоше (провинция Новая Шотландия, Канада) и которому в конечном счете удалось способствовать подписанию договора о запрещении ядерных испытаний. Такая серьезная общественная и личная озабоченность по поводу опасности заражения атмосферы радиоактивными веществами привела к тому, что в 1958 г., несмотря на отсутствие какого бы то ни было договора, США, СССР и Великобритания добровольно прекратили испытания ядерного оружия в атмосфере.
Однако усилия П., направленные на то, чтобы добиться запрета испытаний ядерного оружия в атмосфере, встречали не только поддержку, но и значительное сопротивление. Такие известные американские ученые, как Эдвард Теллер и Уиллард Ф. Либби, оба члены Комиссии по атомной энергии США, утверждали, что П. преувеличивает биологические последствия выпадения радиоактивных осадков. П. также наталкивался на политические препятствия из-за приписываемых ему просоветских симпатий.
Как это ни странно, но в тот же самый период П. подвергался нападкам и в Советском Союзе, поскольку его резонансная теория образования химических связей считалась противоречащей марксистскому учению. (После смерти Иосифа Сталина в 1953 г. эта теория была признана в советской науке.) П. дважды (в 1955 и 1960 гг.) вызывали в подкомиссию по вопросам внутренней безопасности сената США, где ему задавали вопросы относительно его политических взглядов и политической деятельности. В обоих случаях он отрицал, что когда бы то ни было являлся коммунистом или симпатизировал марксистским взглядам. Во втором же случае (в 1960 г.) он, рискуя вызвать обвинение в презрении к конгрессу, отказался назвать имена тех, кто помог ему собрать подписи под воззванием 1957 г. В конце концов дело было прекращено.
В июне 1961 г. П. и его жена созвали конференцию в Осло (Норвегия) против распространения ядерного оружия. В сентябре того же года, несмотря на обращения П. к Никите Хрущеву, СССР возобновил испытания ядерного оружия в атмосфере, а на следующий год, в марте, это сделали США. П. начал вести дозиметрический контроль над уровнями радиоактивности и в октябре 1962 г. сделал достоянием гласности информацию, которая показывала, что из-за проводимых в предыдущем году испытаний уровень радиоактивности в атмосфере поднялся вдвое по сравнению с предшествующими 16 годами. П. также составил проект предлагаемого договора о запрещении таких испытаний. В июле 1963 г. США, СССР и Великобритания подписали договор о запрещении ядерных испытаний, в основе которого лежал проект П.
В 1963 г. П. был награжден Нобелевской премией мира 1962 г. В своей вступительной речи от имени Норвежского нобелевского комитета Гуннар Ян заявил, что П. “вел непрекращающуюся кампанию не только против испытаний ядерного оружия, не только против распространения этих видов вооружений, не только против самого их использования, но против любых военных действий как средства решения международных конфликтов”. В своей Нобелевской лекции, названной “Наука и мир” (“Science and Peace”), П. выразил надежду на то, что договор о запрещении ядерных испытаний положит “начало серии договоров, которые приведут к созданию нового мира, где возможность войны будет навсегда исключена”.
В том же году, когда П. получил свою вторую Нобелевскую премию, он вышел в отставку из Калифорнийского технологического института и стал профессором-исследователем в Центре изучения демократических институтов в Санта-Барбаре (штат Калифорния). Здесь он смог уделять больше времени проблемам международного разоружения. В 1967 г. П. также занял должность профессора химии в Калифорнийском университете (Сан-Диего), надеясь проводить больше времени за исследованиями в области молекулярной медицины. Спустя два года он ушел оттуда и стал профессором химии Стэнфордского университета в Пало-Альто (штат Калифорния). К этому времени П. уже вышел в отставку из Центра изучения демократических институтов.
В конце 60-х гг. П. заинтересовался биологическим воздействием витамина С. Ученый и его жена сами стали регулярно принимать этот витамин, П. же начал публично рекламировать его употребление для предотвращения простудных заболеваний. В монографии “Витамин С и простуда” (“Vitamin C and the Common Cold”), которая вышла в 1971 г., П. обобщил опубликованные в текущей печати практические свидетельства и теоретические выкладки в поддержку терапевтических свойств витамина С. В начале 70-х гг. П. также сформулировал теорию ортомолекулярной медицины, в которой подчеркивалось значение витаминов и аминокислот в поддержании оптимальной молекулярной среды для мозга. Эти теории, получившие в то время широкую известность, не нашли подтверждения в результатах последующих исследований и в значительной мере были отвергнуты специалистами по медицине и психиатрии. П., однако, придерживается точки зрения, что основания их контраргументов далеко не безупречны.
В 1973 г. П. основал Научный медицинский институт Лайнуса Полинга в Пало-Альто. В течение первых двух лет он был его президентом, а затем стал там профессором. Он и его коллеги по институту продолжают проводить исследования терапевтических свойств витаминов, в частности возможности применения витамина С для лечения раковых заболеваний. В 1979 г. П. опубликовал книгу “Рак и витамин С” (“Cancer and Vitamin С”), в которой утверждает, что прием в значительных дозах витамина С способствует продлению жизни и улучшению состояния больных определенными видами рака. Однако авторитетные исследователи раковых заболеваний не находят его аргументы убедительными.
В 1922 г. П. женился на Аве Элен Миллер, одной из его студенток в Орегонском государственном сельскохозяйственном колледже. У супругов три сына и дочь. После смерти жены в 1981 г. П. живет в их загородном доме в Биг-Сюре (штат Калифорния).
Помимо двух Нобелевских премий, П. был удостоен многих наград. В их числе: награда за достижения в области чистой химии Американского химического общества (1931), медаль Дэви Лондонского королевского общества (1947), советская правительственная награда - международная Ленинская премия “За укрепление мира между народами” (1971), национальная медаль “За научные достижения” Национального научного фонда (1975), золотая медаль имени Ломоносова Академии наук СССР (1978), премия по химии американской Национальной академии наук (1979) и медаль Пристли Американского химического общества (1984). Ученому присвоены почетные степени Чикагского, Принстонского, Йельского, Оксфордского и Кембриджского университетов. П. состоит во многих профессиональных организациях. Это и американская Национальная академия наук, и Американская академия наук и искусств, а также научные общества или академии Германии, Великобритании, Бельгии, Швейцарии, Японии, Индии, Норвегии, Португалии, Франции, Австрии и СССР. Он был президентом Американского химического общества (1948) и Тихоокеанского отделения Американской ассоциации содействия развитию науки (1942...1945), а также вице-президентом Американского философского общества (1951...1954).
Источник информации:
Лауреаты Нобелевской премии: Энциклопедия: Пер. с англ.- М.: Прогресс, 1992.
Теоретически предсказываемые величины двухгранных углов в наиболее изученной правой а-спирали должны быть равны: φ = -58∘, а ψ = -41∘. По данным РСА ряда белков их усредненные значения равны: φ = -62∘, а ψ = -41∘. Такие величины углов обеспечивают максимальную стабильность структуры. Эта стабильность достигается тем, что в ней практически нет стерических затруднений, особенно для R-боковых цепей - раз. Во-вторых, диполи С=О и N-Н пептидных связей ориентированы почти коаксиально, что является оптимальным для диполь-дипольного взаимодействия и обеспечивает образование обширной системы внутримолекулярных кооперативных водородных связей. Они надежно стабилизируют а-спираль.
Образование водородных связей внутри цепи является прямым следствием того, что планарная пептидная группировка находится в транс-форме. В а- спирали каждая NH-группа пептидной цепи связана водородной связью с С=О группой четвертой аминокислоты, образую при этом 13-членный цикл. Поэтому а-спираль обозначают иногда как 3.613-спираль (3.6 аминокислотных остатка в 16-членном цикле). Если расположить а-спираль N-концом вверх, то все С=О группы будут направлены вниз, а NH - вверх.
Другая характерная особенность а-спирали следует непосредственно из комбинации значений углов φ и ψ: шаг спирали (один полный виток) 5.4Å составляют 3.6 аминокислотных остатка на виток. Угол поворота цепи на один аминокислотный остаток составляет: 360∘/3.6 = 100∘. Диаметр спирали (без учета боковых групп) равен 6Ä. Для L-аминокислот правовращающая спираль выгодно отличается от левовращающей, тем что R-группы аминокислот направлены наружу от центральной оси, что резко уменьшает стерические напряжения. Кроме того, за счет повернутых вовне R-остатков обеспечивается гидровильность или гидрофобность пептидной - цепи.
Содержание а-спиралей в глобулярных белках сильно варьирует: от полного отсутствия (нейротоксин змей, например) до 80-90%. Миоглобин и гемоглобин содержат 75% спиралевидных участков, альбумин сыворотки - 50%, рибонуклеаза - 17%, химотрипсин - 8%.
Белок не может иметь в цепи 100% а-спиралей и сохранять глобулярность. Он в этом случае будет фибриллярным. Более того, если имеется а- спираль, она находится, как правило, в одном, двух или нескольких отдельных участках цепи. Спиральная структура нарушается многими факторами. Например, наличием остатка пролина, циклическая структура которого вносит излом в пептидную цепь; наличием локального электростатического отталкивания, обусловленного кластером положительно заряженных R-групп лизина и аргинина, либо кластером отрицательно заряженных R-групп глутаминовой и аспарагиновой кислот и др. причинами. Неспиральная часть пептидной цепи может иметь структуру складчатого листа либо статистического клубка.
Помимо а-спирали, известны и другие виды спиралей. Они различаются между собой числом аминокислотных остатков на виток. Например, 310-спираль содержит три остатка в 10-членном цикле, 4.316- или п-спираль (4.3 аминокислотных остатка в 16-членном цикле. 310-Спираль и п-спираль в реальных белках встречаются крайне редко и только в очень коротких участках пептидной цепи (например, в миоглобине и лизоциме). Левые 310- и п-спирали в природных белках пока не обнаружены.