Химия белка. Структура, свойства, методы исследования - Шендрик А.Н. 2022
Структура белков
Пространственная структура белков
Вторичная структура белков - Структура складчатого листа
Структура типа складчатого листа также стабилизирована кооперативными водородными связями между теми же диполями. Совершенно новая структура образуется в этом случае за счет межмолекулярных водородных связей между двумя или большим числом цепей (в фибриллярных белках) или внутримолекулярных водородных связей между различными участками одной цепи (в глобулярных белках). Полинг и Кори постулировали “плоские” параллельный и антипараллельный ß-складчатые листы.
В параллельном складчатом листе обе пептидные цепи или два разных участка одной и той же пептидной цепи имеют в пространстве одно направление, т. е. параллельны. В антипараллельном складчатом листе цепи направлены в противоположные стороны, т.е антипараллельны. В природных белках и пептидах встречаются обе структуру, но антипараллельная является более стабильной, поэтому и более распространенной. В ней диполи С=О и N-Н расположены параллельно или соосно.
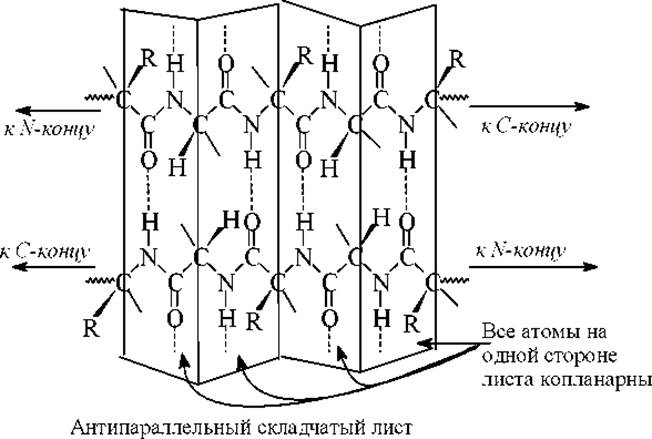
Фрагменты параллельной и антипараллельной структур типа складчатого листа приведены на рисунках.
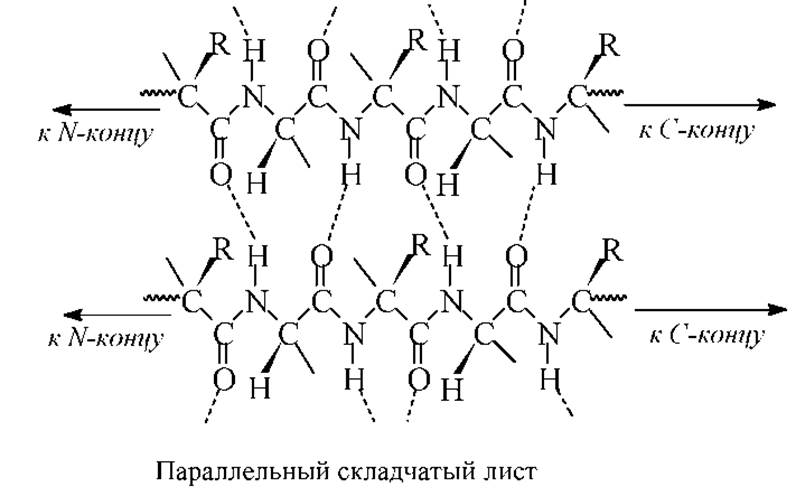
Расположение R-групп в складчатых листах следующее. Если смотреть вдоль полипептидного остова, то R-группы находятся то над плоскостью, то за плоскостью листа. Складчатые структуры встречаются довольно часто. Наиболее характерный пример - ß-фиброин шелка, который имеет структуру антипараллельного складчатого листа. Участки молекулы фиброина имеют повторяющийся структурный фрагмент: Гли-Ала-Гли-Сер-Гли-Ала. При образовании ß-антипараллельной структуры R-группы Ала и Сер располагаются по одну сторону, а Гли - по другую (получается как бы ворс с одной стороны). Поскольку слои связаны между собой только невалентными взаимодействиями, шелк очень эластичен.
Большинство складчатых листов не являются плоскими. Они характеризуются левой закруткой, если смотреть вдоль плоскости листа перпендикулярно его вытянутым цепям. Фактически можно сказать, что лист - это очень растянутая левая спираль.
Длинна скрученного листа неограниченна. ß-Фиброин шелка содержит очень длинные скрученные ленты складчатого листа.
а-Спираль и ß-структура представлены в белках отдельными иногда достаточно короткими отрезками. Значительную часть пептидной цепи составляет различного рода петли, которые позволяют изменить направление цепи. Наиболее экономный структурный элемент, позволяющий повернуть пептидную цепь на 180∘, назван ß-изгибом. ß-Изгибы образуются четырьмя последовательно расположенными аминокислотными остатками с водородной связью 4→1 (цикл из 10 атомов). Две возможные структуры ß-изгибов приведены ниже:
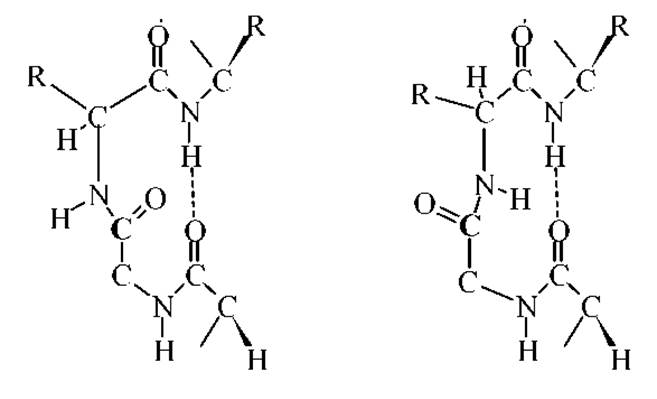
Анализ поворотов цепей в глобулярных белках показал, что 65% из них являются ß-изгибами (их называют еще ß-шпильками). Третья аминокислота в ß- шпильках - глицин. Другие виды поворотов, как правило, не содержат водородных связей. Иногда такие нестандартные изгибы содержат фрагмент Цис-Про. Большинство реверсивных поворотов находится на поверхности белка. Они содержат в основном гидрофильные остатки.