Химия белка. Структура, свойства, методы исследования - Шендрик А.Н. 2022
Методы экспериментального исследования структуры белков
Оптические свойства белков
Одним из важнейших оптических свойств пептидов и белков является вращение плоскости поляризации света, или оптическая активность. Оптическая активность складывается из двух составляющих.
1. Первая составляющая - это сумма инкрементов всех асимметричных а-С атомов, которые входят в пептидную цепь. В пептидной цепи все а-С атомы вращают плоскость поляризации, как правило, влево. Иными словами, аминокислоты в свободном состоянии и аминокислоты в включенные пептидную цепь могут вращать плоскость поляризации в разные стороны. Причина в том, что направление и угол вращения молекулами свободных аминокислот существенно зависят от состояния амино-, карбокси- и других диссоциирующих групп в боковом R-радикале, состава раствора, его рН и некоторых других факторов среды. При образовании пептидной цепи вблизи асимметричного атома С всегда расположены незаряженные СО-NH- группы пептидной связи, что устраняет сложное влияние зарядов на величину угла вращения. В результате, инкременты для а-С- атомов различных аминокислот выравниваются (он оказывается практически одним и тем же). Для концевых аминокислот этого эффекта нет, но вклад этих двух атомов в суммарную величину удельного вращения всей пептидной цепи крайне мал.
При анализе этого вопроса на практике, вместо эмпирической величины удельной оптической активности [а] пользуются так называемым эффективным вращением звена цепи [m], выражая его в виде:
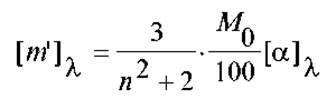
где М0 - ММ звена, n - показатель преломления среды.
Рассмотрим примеры для пептидов не имеющих хорошо организованной вторичной структуры, т.е. находящихся в состоянии статистического клубка. Так, полиглютаминовая кислота в щелочной среде (когда она полностью ионизирована и несет на себе максимальный отрицательный заряд, т.е. не имеет спиральной конформации) имеет величину [a]D = -107∘ (удельная активность измеренная при D-линии натрия, 589,3 mμ). Величина [m]Dпри М0=129, n=1.37 составляет:
![]()
Для полилизина в 6 N соляной кислоте [а]D=-800, M0=13°, n=1.38. Откуда [m]D= -82°. Как видно, структура боковой цепи аминокислот не очень сильно влияет на величину эффективного угла вращения звена. Подобные колебания наблюдаются и в белках. Для денатурированных белков [m] заключено в пределах от -85 до -100°. Эти колебания отражают различия в аминокислотном составе белков.
2. Вторая составляющая оптической активности белков определяется структурой макромолекулы как целого. Если а-спираль является основным элементом вторичной структуры пептидной цепи, то она должна давать большой вклад в величину оптической активности. Обычно он колеблется в пределах от 80 до 100-1050. В самом общем случае цепь главных валентностей правой спирали вращает плоскость поляризации вправо, а левой - влево. Поскольку природные белки, состоящие из L-аминокислот, образуют правую спираль, то для них наблюдается правое вращение. Из всего сказанного напрашивается вопрос: можно ли опираться на параметры оптической активности для установления самого факта наличия спиральной структуры в пептидной цепи и можно ли, выполнив соответствующую калибровку, оценивать степень спирализации пептидной цепи? Абсолютно точный и абсолютно утвердительный ответ на эти вопросы пока дать нельзя. Единственное, что можно утверждать с абсолютной уверенностью - это то, что упорядочивание макромолекул глобулярных белков проявляется большим положительным инкрементом в оптической активности.
Типичная кривая изменения оптической активности в процессе, например, тепловой денатурации белка приведена на рис. 4.1.
Сам по себе факт распада упорядоченной структуры, который проявляется изменением оптической активности, не есть доказательством существования обязательно а-спирали или какой-либо спирали вообще. Только по совокупности данных различных методов исследования может быть принят такой вывод.
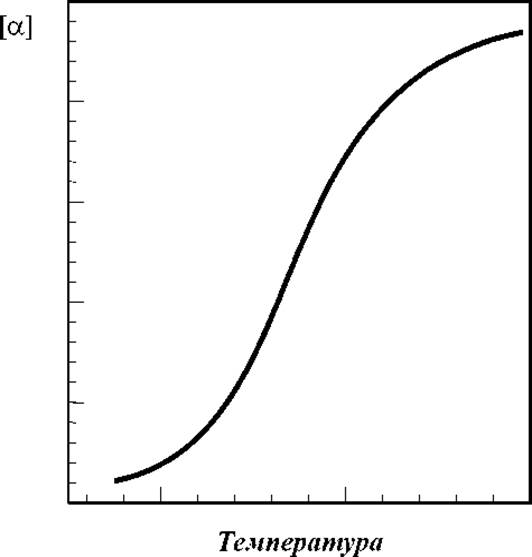
Рис. 4.1 Типичная кривая плавления вторичной структуры белков