Химия белка. Структура, свойства, методы исследования - Шендрик А.Н. 2022
Методы экспериментального исследования структуры белков
Оптические свойства белков
Дисперсия оптической активности
Под дисперсией оптической активности понимают зависимость величины удельного вращения от длинны волны облучающего света. Теория этого явления в приложении к спиральным пептидным цепям (в том числе и в белках) разрабатывалась Моффитом.
Дисперсия оптического вращения в простых случаях соединений с отдельными хиральными атомами углерода описывается уравнением Друде:
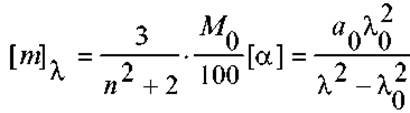
Оно хорошо согласуется с опытом при длинах волн не слишком близких к полосе поглощения атомов или групп, соседних с асимметричным атомом углерода (λ0). Системы, которые описываются одночленным уравнением Друде имеют простые кривые оптической дисперсии. В то же время, для многих систем, включая белки и пептиды, уравнение Друде неприемлемо, поскольку вблизи λ0 должна наблюдаться так называемая аномальная дисперсия. В уравнении Друде - это точка разрыва (деление на ноль), при приближении к которой оптическая активность должна стремиться к бесконечности. Этот факт отражает в действительности лишь ограниченность уравнения Друде (как, например, и закона Кулона или Ньютона при r→0). На практике оптическая активность возрастает, однако зависимость ее от λ весьма своеобразная (см. рис.), а наблюдаемый эффект получил название Коттон-эффекта.
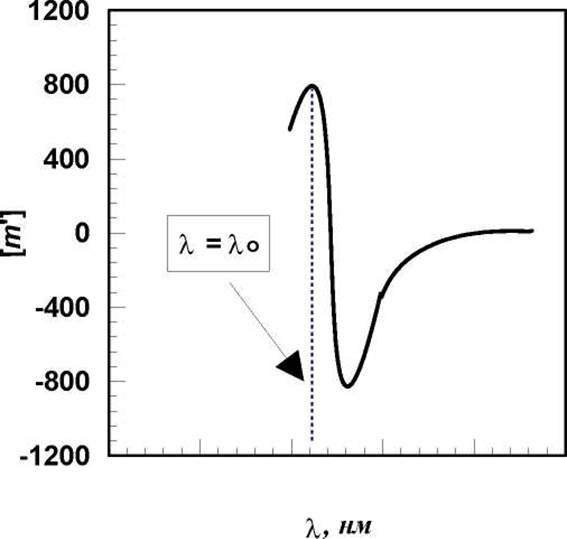
Вблизи полосы поглощения (λ=λ0) оптическая активность сильно возрастает, проходит через максимум и стремительно падает. Затем, изменив свой знак, проходит через такой же глубокий минимум и выполаживается (см.рис.). Для белков максимум оптической активности наблюдается при 230 нм.
Явление Коттон-эффекта учитывает эмпирическое двухчленное уравнение, предложенное Моффитом и Янгом:
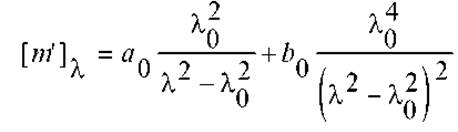
где [m’]λ - приведенное среднее вращение остатка.
Коэффициенты а0 и b0 определяют экспериментально. Для этого, последнее уравнение приводят к виду:
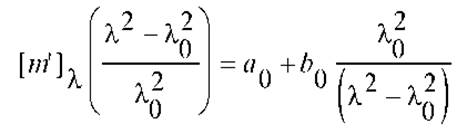
и строят график прямой:
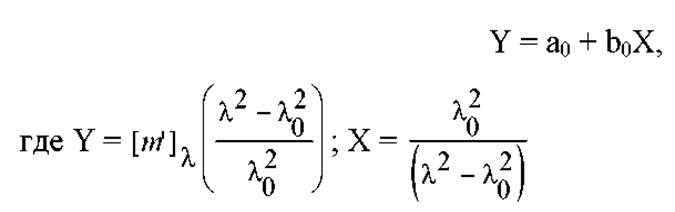
На рисунке, в качестве примера, представлены данные в координатах прямой для дисперсии оптического вращения синтетического пептида (λ0 = 212 нм). Этот пептид представляет собой сополимер следующего состава: 5% L-тирозина и 95% L-глутаминовой кислоты (результаты получены Уорнесом и Доти).
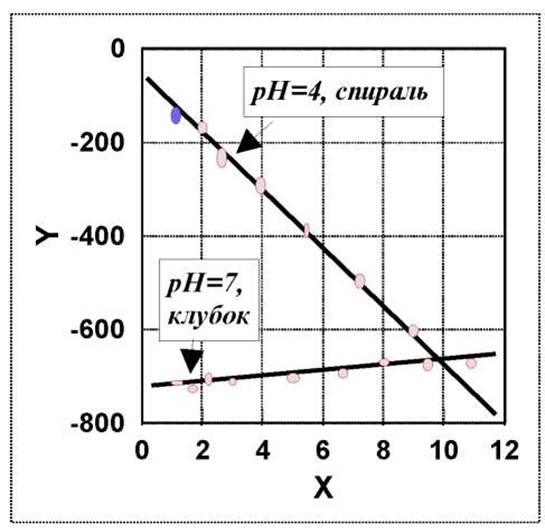
Величина а0 - отражает вращение, обусловленное природой аминокислотных остатков, b0 - взаимодействие в а-спиральных участках пептидной цепи. Переход от спиральной структуры к неупорядоченной сопровождается уменьшением величины углового наклона (b0). Для правой спирали в неполярных растворителях характерна величина b0 порядка -630. Для неупорядоченных структур в полярных растворителях эта величина приближается к нулю (см. рис).
Наблюдение Коттон-эффекта в белках может служить, таким образом, некоторой характеристикой их вторичной структуры. Надо заметить, однако, что в белках вариации b0выражены значительно хуже, чем в синтетических пептидах.