Химия белка. Структура, свойства, методы исследования - Шендрик А.Н. 2022
Методы экспериментального исследования структуры белков
Оптические свойства белков
Поглощение белками света в УФ-, видимой и ИК-областях спектра
В видимой области поглощают только хромопротеиды - белки, которые содержат в своем составе пигмент. Это, например, белки в состав которых входит гем (порфириновое кольцо с ионом железа): миоглобин, гемоглобин, цитохромы, каталаза, пероксидаза и др.
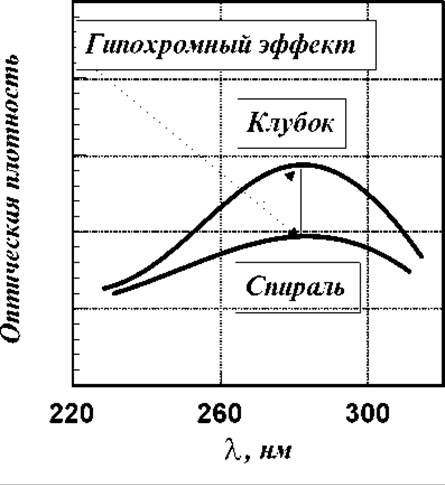
В УФ-области все белки, кроме протаминов, имеют широкую полосу поглощения в области 275-285 нм (ядра тирозина, триптофана, фенилаланина). Оптическая плотность (коэффициент экстинкции) при структурировании аморфного белка в спираль уменьшается. Длина волны в максимуме полосы поглощения не изменяется. См. рисунок:
Это явление носит название гипохромного эффекта. Вначале он был открыт для нуклеиновых кислот, а затем, много позже, для пептидов и белков. По величине гипохромного эффекта можно судить о степени включения пептидной цепи в спираль.
В ИК-области спектра важные полосы поглощения белковых молекул обусловлены пептидной связью (группами С=О и NH): 3300 см-1 - валентные колебания NH группы, 1660 - валентные колебания С=О, 1550 - деформационные колебания NH. Исследование ИК-спектров также позволяет сделать некоторые заключения о вторичной структуре пептидных цепей белков.