Химия белка. Структура, свойства, методы исследования - Шендрик А.Н. 2022
Методы экспериментального исследования структуры белков
Методы очистки белков
Частные методы разделения белков
Ультрацентрифугирование. Метод ультрацентрифугирования основан на том, что взвешенные в растворе белковые молекулы оседают на дно сосуда в мощном гравитационном поле со скоростями пропорциональными их массам и плотностям. Чем больше масса и плотность, тем скорее белок оседает. Основы метода ультрацентрифугирования изложены в разделе посвященном методам определения молекулярной массы белков.
Теоретически, эффективность разделения смесей методом центрифугирования должна быть высокой. Практически, однако, это далеко не так.
Гель-фильтрация. Для проведения препаративной гель-фильтрации белков чаще других носителей используют сефадексы. Причина в том, что число сшивок в гелях на основе сефадексов легко регулируется в процессе получения этих сетчатых (пористых) носителей для хроматографии количеством введенного эпихлоргидрина (сшивающего агента):
![]()
Тем самым достигается получение сефадексов с различным количеством и размером ячеек. Серийно выпускаемые типы сефадексов и размеры белковых молекул, которые с их помощью можно расфракционировать приведены в разделе посвященном гель-хроматографии.
В отечественной и зарубежной литературе гель-колоночную хроматографию подразделяют нередко на гель-проникающую хроматографию (ГПХ) и гель-фильтрацию. Принципиальной разницы между этими двумя понятиями нет. Просто термин "гель-фильтрация" используют чаще при работе с водными растворами и гидрофильными гелями. Как правило, фильтрование через гель используется в биохимических исследованиях биологических полимеров. В ГПХ применяются преимущественно органические растворители и гидрофобные гели. Этот вариант анализа широко используется при исследованиях синтетических высокомолекулярных соединений. Схема разделения смеси белков методом гель-фильтрации сводится к следующему.
> Проводят процедуру набухания сефадекса в разбавленном растворе хлорида натрия. Он предотвращает слипание гранул сефадекса.
> Заполняют колонку полученным гелем.
> Вводят смесь белков в колонку. Объем смеси должен быть во много раз меньше объема гель-фазы.
> Пропускают через колонку растворитель (буферный раствор). Находящиеся в составе анализируемого образца молекулы малых размеров постоянно сорбируются и десорбируются порами геля. Этот процесс многократной сорбции-десорбции замедляет продвижение малых молекул по колонке. Более крупные молекулы движутся скорее. И молекулы размеры которых больше размеров ячеек геля вообще не поглощаются им и, “обтекая” гранулы геля быстро движутся с током растворителя к выходу из колонки. Собирая небольшими порциями элюэнт на выходе из колонки можно получить хорошо обособленные фракции отдельных белков.
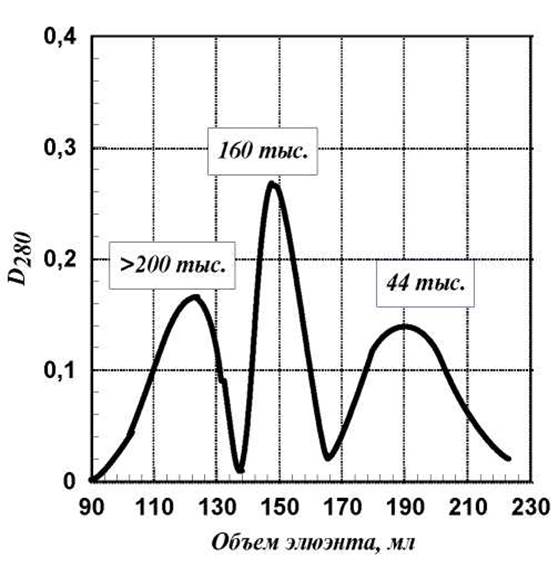
Конкретный пример по разделению смеси яичного альбумина, ММ=44тыс. (антиген); имунного у-глобулина, ММ=160тыс. (антитело) и продукта их рекомбинации (комплекс антиген-антитело), ММ > 200тыс. на сефадексе G-200 представлен на рисунке.
Отметим, что при гель-фильтрации на сефадексе белки практически не адсорбируются гелем, т.е. процесс протекает как молекулярная фильтрация. Существенно также то, что сефадексы не разрушают лабильные белки.
В ряде случаев метод гель-фильтрации сочетают с процессом ионного обмена. Для этой цели выпускаются ионообменные смолы на основе сефадекса - ДЭАЭ-сефадексы, КМ-сефадексы и некоторые другие.
В процессе фракционирования на сефадексах можно одновременно определять и молекулярную массу белков. Эндрюс установил, что скорость движения белков с ММ от 4000 до 160000 на сефадексах G-75 и G-100 практически линейно зависит от логарифма ММ белка.
Метод гель-фильтрации применяется не только для фракционирования белков, но и для освобождения белков от примесей низкомолекулярных соединений (в том числе и солей). Кроме того, сухой гель можно использовать для концентрирования белков в растворах. Для этого в раствор белка засыпают гранулы сефадекса, например. В процессе набухания он поглощает воду и низкомолекулярные компоненты раствора, а белки остаются в меньшем количестве растворителя, т.е. концентрируются. После полного набухания гель отделяется от раствора центрифугированием.
Помимо сефадексов в препаративном разделении белков используют сефарозы и гели на основе полиакриламида (биогели). Типы этих гелей и ММ разделяемых с их помощью белков мы рассмотрим несколько позже.