Химия белка. Структура, свойства, методы исследования - Шендрик А.Н. 2022
Методы экспериментального исследования структуры белков
Методы разделения белков
Экспериментальные методы электрофореза - Метод изоэлектрофокусировки
Для выделения белков и анализа их смесей разработан весьма эффективный метод электрофореза, названный изоэлектрофокусировкой (ИЭФ). Он основан на различиях в изоэлектрических точках белков. Напомним, что в изоэлектрической точке молекула белка имеет суммарный нулевой заряд. Метод ИЭФ позволяет различать белки, для которых величины рI отличаются всего на 0.01-0.0025 единиц рН. В качестве геля в ИФ используют ПААГ или агарозные гели.
Вначале гель погружают в раствор со смесью низкомолекулярных солей и амфолитов. В качестве соли используют, например, сульфат натрия. При пропускании через гель тока (в приложенном извне электрическом поле) у катода накапливается щелочь (гидроксид натрия), а у анода кислота (серная). Амфолит - это амфотерное вещество. У катода, оно в щелочной среде приобретает отрицательный заряд и движется к аноду. У анода, в кислой среде, амфолит заряжен положительно и начинает двигаться к катоду. Через некоторое время амфолит переместится от электродов и окажется в той части колонки, где величина рН равна его изоэлектрическому значению. Если в систему ввести несколько амфолитов с разными величинами ИЭТ, то они распределятся по колонке, формируя в ней градиент рН. Этот градиент рН поддерживается в течении всего времени проведения эксперимента. В качестве амфолитов используются вещества, содержащие в своих молекулах одновременно кислотные и основные группы. Основными являются чаще всего аминогруппы (первичные, вторичные, третичные), гуанидиновые группы. Кислотными - карбоксильная, сульфо- и фосфогруппы. Обобщенная формула амфолита:
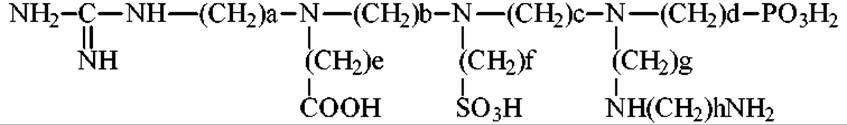
Молекулярная масса амфолита должна быть небольшой. Обычно она изменяется от 300-600 до 1000. Это позволяет легко отделять их от макромолекул по окончанию эксперимента. В настоящее время различные амфолиты производятся серийно. Торговые названия - “амфолины”, “сервалиты” и др. Они различаются по интервалам градиента рН, например 3-5, 7-10, 3.5-10, 4-4.5 и т.д. Максимальный интервал рН 2-11.
После подготовки колонки и создания в ней градиента рН на гель наносят образец смеси белков и проводят электрофорез. При прохождении через зоны с различными величинами рН белки “титруются” и изменяют свой суммарный заряд. Миграция и титрование продолжаются до тех пор пока каждый компонент не достигнет такого значения рН, при котором белок оттитрован до изоэлектрического состояния. В этой зоне белок утрачивает электрофоретическую подвижность (Q=0) и больше не перемещается вдоль трубки с гелем. Результатом есть то, что первоначальная белковая смесь распределяется по трубке с гелем на весьма узкие зоны по значениям рI. Ширина зон при ИЭФ существенно меньше, чем при обычном электрофорезе.
По сути говоря изоэлектрофокусировка есть скорее самостоятельный метод исследования, чем разновидность электрофореза. Электрофореза, в чистом виде при ИЭФ нет. Остановимся очень кратко на сути электрофокусировки. Рассмотрим поведение белка с ИЭТ рН=6 в трубке со стабилизированной средой в градиенте рН от 3 до 10 при прохождении через нее постоянного тока (см. рис. 4.8).
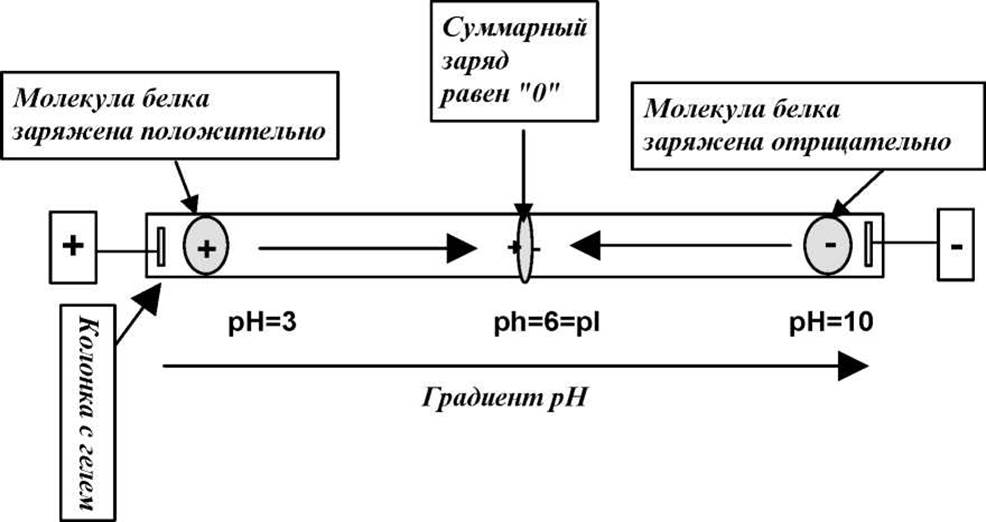
Рис. 4.8 Принципиальная схема изоэлектрофокусировки белка
Молекулы белка в области рН > pI будут нести на себе положительный заряд и двигаться в электрическом поле по направлению к катоду. Молекулы этого же белка в области рН < pI имеют отрицательный заряд и будут двигаться в противоположном направлении, т.е. в сторону анода. В точке рН = рІ молекулы белка электронейтральны и электрическое поле на них не действует. В этой точке поле пытается как бы спрессовать молекулы белка с двух сторон, т.е. сфокусировать их в очень узкую полоску.
Таким образом, основное различие между изоэлектрической фокусировкой и электрофорезом состоит в том, что при ЭФ молекулы белка просто перемещаются в одном направлении вдоль колонки под действием электрического поля со скоростями пропорциональными их электрофоретической подвижности. При этом, движение заряженной молекулы через колонку будет продолжаться до тех пор, пока она не достигнет соответствующего электрода. При ИЭФ картина иная. Заряженная молекула белка движется в направлении своей ИЭТ и постоянно уменьшает свой суммарный заряд. ИЭТ есть, таким образом, предельная точка движения молекулы вдоль колонки. Достигнув этой точки молекула останавливается и не может сместится даже под действием сил диффузии ни в одну ни в другую сторону от ИЭТ. Это ясно из приведенного рисунка. По этой собственно причине электрическое поле как бы “разносит” белковую смесь по соответствующим ИЭТ, т.е. фокусирует белки в этих точках, сжимая их в очень узкие зоны.
Схема миграции белков в процессе ИЭФ и устройства для проведения ИЭФ приедены на рис. 4.9; 4.10 соответственно.
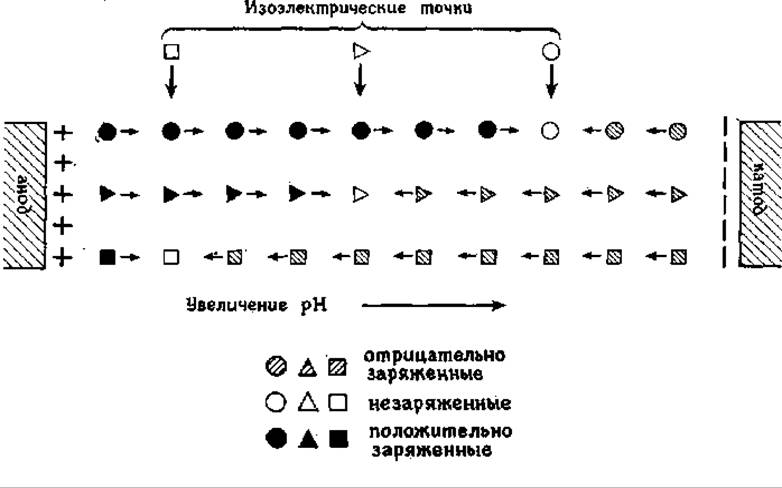
Рис. 4.9 Схема процесса миграции белков с различными величинами рІ в электрическом поле
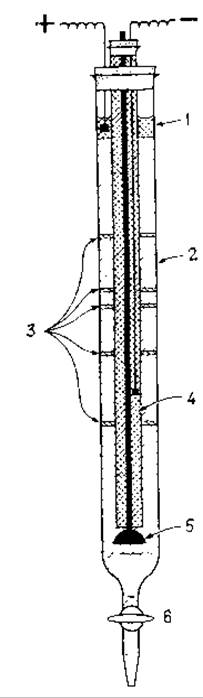
Рис. 4.10 Схема установки для проведения изоэлектрофокусировки белков
1. фосфорная кислота;
2. амфолит + сахароза, создающие градиент рН и плотности среды
3. зоны расположения белков с различными величинами рІ после завершения процесса ИЭФ
4. заполненная триэтаноламином катодная трубка
5. запорный клапан
6. сливной кран
Основные закономерности процесса ИЭФ описываются уравнением Свенссона:
![]()
где с - концентрация; μ - подвижность; i - сила тока; k - проводимость; q - поперечное сечение колонки; D - коэффициент диффузии; х - координата вдоль оси колонки в направлении от анода к катоду.
Ниже, на рисунке, в качестве примера приведена фотография результата анализа методом ИЭФ сложной белковой смеси после окрашивания геля.
