Принципы структурной организации белков - Г. Шульц 1982
Эволюция белков
Дифференциация белков
Трипсиноподобные сериновые протеазы
Трипсиноподобные сериновые протеазы [138, 536] образуют семейство расщепляющих белки ферментов, которые контролируют многие важнейшие физиологические процессы (табл. 9.4). Пищеварительный фермент трипсин, для которого и был впервые употреблен термин «энзим» (фермент), является наиболее изученным членом этого семейства. Он известен уже более ста лет, а его способность к расщеплению пептидных связей вблизи лизиновых и аргининовых остатков очень сходна со свойствами большей части других белков из этого семейства. Однако большинство родственных трипсину ферментов намного более специфичны, чем сам трипсин: каждый из них расщепляет в белке только одну или очень небольшое число пептидных связей. Структурная гомология сериновых протеаз была изучена и обобщена Хартли в 1970 г. [490]. Попарные сравнения трипсина, эластазы, химотрипсина и тромбина показывают, что около 40% их аминокислотных последовательностей идентичны (58 РАМ). На сегодняшний день известны структуры первых трех из этих ферментов. Как и предсказывалось, все они имеют одинаковую укладку цепи [18, 243—245].
Таблица 9.4 Сериновые протеазы, участвующие в процессах, поддерживающих жизнедеятельность, и в процессах, угрожающих жизни человека
|
Протеаза |
Местонахождение в активном состоянии |
Управляемый (пато)физиологический процесс |
|
Трипсин |
Тонкий кишечник |
Переваривание белка |
|
Тромбин |
а) Кровь б) Воспаленные ткани |
Свертывание крови Отторжение ткани |
|
Плазмин |
Раны и воспаленные ткани |
Растворение временных сгустков фибрина |
|
Акросомальная протеаза спермы |
Яйцеклетка |
Оплодотворение |
|
Компоненты системы комплемента |
Цитоплазматические мембраны бактерий, зараженные ткани |
Разрушение чужеродных клеток, инициация процессов воспаления и т. д. |
|
Калликреин |
Кровь и ткани |
Регуляция кровообращения и ощущение боли |
|
Протеаза оболочки клетки |
Воспаленные ткани |
Разрушение патогенных и эластичных соединительных тканей |
|
М-протеаза |
Клетки саркомы |
Рост опухоли |
|
Д-протеаза |
Клетки миокарда и другие клетки |
Освобождение смертоносного дифтерийного фермента от токсина |
Последовательности протеазы В и химотрипсина можно сопоставить на основании их трехмерной структуры. Трипсиноподобные ферменты были обнаружены также в микроорганизмах. Streptomyces griseus, например, содержит так называемую проте(ин)азу В, которая включает только 186 остатков (по сравнению с 234 в химотрипсине). Данные рентгеноструктурного анализа показывают, что укладка цепи протеазы В очень сходна с укладкой цепи химотрипсина [246]. Как можно заключить из трехмерных структур, делеции и вставки происходят только на поверхности молекулы. Это видно из рис. 9.4. Ранее уже говорилось о том, что сохранение внутренней части белка можно рассматривать как общее правило. В результате сопоставления аминокислотных последовательностей на основе геометрических данных выяснилось, что идентичны только 13% остатков, что отвечает генетическому расстоянию между химотрипсином и протеазой В в 432 РАМ. При таком расстоянии невозможно установить гомологичность белков только по их аминокислотным последовательностям (разд. 9.6 и работа [803]).
Расположение остатков в каталитическом центре, своеобразном химическом ноже для расчленения пептидных связей, очень хорошо сохранилось во всех сериновых протеазах, тогда как специфичность к субстрату претерпела значительные изменения. Этот факт может означать, что каталитический механизм достиг физико-химического оптимума [537, 538]. Однако существуют и другие возможности для расщепления пептидных связей; в различных семействах протеиназ [145, 539] действуют разные каталитические механизмы.
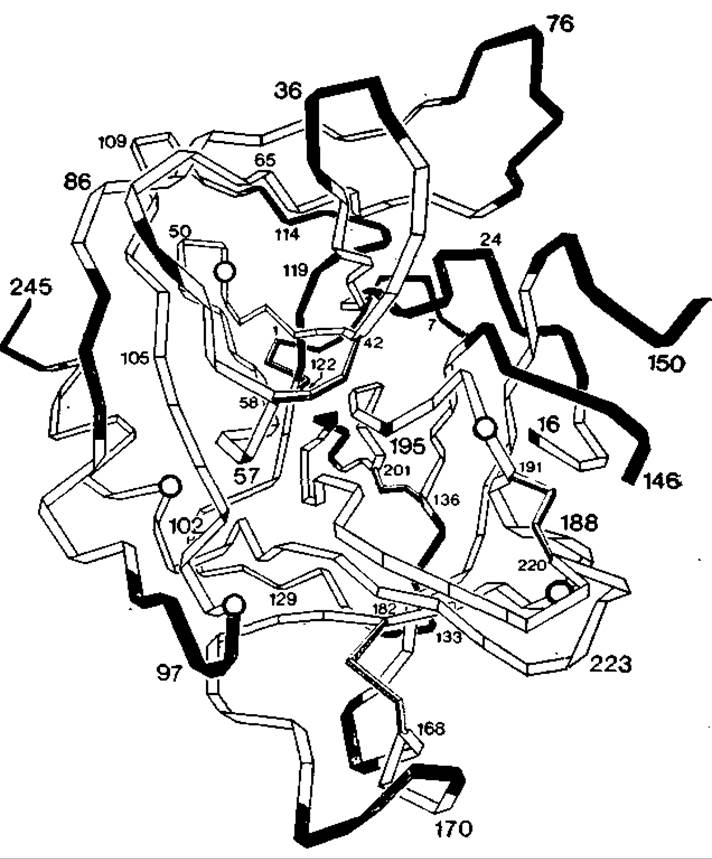
Рис. 9.4. Полипептидные цепи а-химотрипсина и протеазы В из Streptomyces griseus [18]. Цепь химотрипсина показана в виде ленты, прогнутой при каждом атоме Са. Первый ß-структурный цилиндр (рис. 5.17, г) находится в верхней левой части рисунка, а второй — в правой нижней части. Цепь протеазы В свернута так же. Но в ней отсутствуют те части ленты, которые зачернены. Кроме того, имеются вставки в местах, отмеченных на ленте кружками. Отметим, что все вставки и делеции расположены на поверхности молекулы.