Принципы структурной организации белков - Г. Шульц 1982
Взаимодействия белок - лиганд
Центры связывания субстрата сериновых протеаз
Образование комплекса химотрипсина с субстратом
Механизм связывания субстрата аналогичен у всех известных сериновых протеаз [537], включая субтилизин [627]. Поскольку субстратами сериновых протеаз являются белки, выяснение механизма образования комплексов этих ферментов с их субстрата также дает информацию о взаимодействии белок—белок.
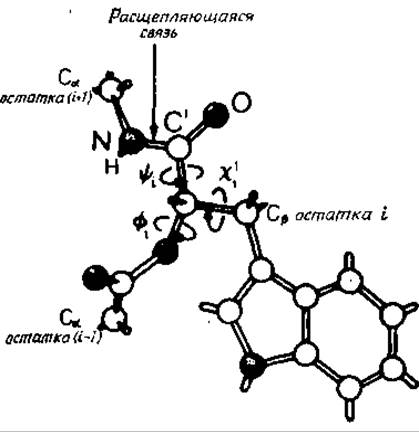
Рис. 10.1. Присоединение субстрата к химотрипсину [537].
Показаны двугранные углы субстрата, которые должны принять определенные значения перед тем, как произойдет расщепление пептидной связи между остатками і и і+1.
Связывание субстрата можно разделить на несколько стадий. В каждой стадии принимают участие взаимодействия с атомами основной цепи химотрипсина. Рассмотрим этапы, предшествующие расщеплению химотрипсином пептидной связи со стороны карбонильного конца аминокислотного остатка і [537, 538]. Этот остаток может быть либо ароматическим, либо нести объемную алифатическую боковую группу. При образовании комплекса расщепляющаяся связь субстрата ориентирована точно по направлению к атакующим группам [537]. Начиная с фиксации боковых цепей, этот процесс можно разделить на несколько стадий. Для этих стадий следует отметить важность взаимодействий, в которых участвуют неподвижные атомы основной цепи.
а) Боковая цепь і, включая Сβ-атом (рис. 10.1), попадает в глубокий карман фермента, образованный тремя пептидными связями, и фиксируется гидрофобными взаимодействиями. Форма входа в карман оставляет мало позиционной свободы для Са-атома этого остатка.
б) При фиксированной боковой цепи двугранный угол χ1і (рис. 2.2 и 10.1) определяет положение основной цепи субстрата. Допустимую вариацию χ1і определяет поверхность фермента. Значение χ1і фиксируется образованием водородной связи между NH-группой остатка субстрата и карбонильной группой остатка 214 основной цепи, вследствие чего фиксируется также угол —і.
в) После установления этих взаимодействий необходима фиксация угла ψі. Выбор в этом случае также контролируется профилем поверхности фермента, который допускает для угла только два интервала значений. Одна из этих возможностей позволяет карбонильной группе остатка і образовать водородные связи с NH-гpyппами остатков 193 и 195, входящих в основную цепь. Это приводит к сближению амидной группы расщепляющейся связи (т. е. NH-группы остатка і + 1 субстрата) с центром химического управления фермента — линейной «релейно-зарядной системой» [628], состоящей из боковых цепей Asp, His и Ser. Теперь можно считать, что фермент-субстратный комплекс (комплекс Михаэлиса) образован и пептидная связь между остатками і и і + 1 готова к ферментативной атаке.
Непродуктивное связывание предотвращает гидролиз пептидов, состоящих из нежелательных D-аминокислот. Пептиды, состоящие из D-аминокислот, также могут прочно связываться химотрипсином. Однако в этом случае образуется сравнительно малореакционноспособный фермент-субстратный комплекс, поскольку расщепляющаяся связь не ориентирована должным образом относительно каталитического центра [629]; таким путем свободная энергия связывания расходуется на ингибирование реакции с аналогом субстрата, которая могла бы привести к нежелательным продуктам. Непродуктивное связывание, по-видимому, является общим механизмом, обеспечивающим специфичность фермента [630, 631].