Принципы структурной организации белков - Г. Шульц 1982
Структурные основы механизма, действия и функции белков
Скелетная мышца - система, в которой действие белка можно связать с общей деятельностью органа
Структурная и функциональная организация сократительных белков
Главным структурным н функциональным звеном клетки мышцы является саркомер (рис. 11.5) — цилиндрическое образование диаметром 1,5 мкм и длиной 2 мкм, которое содержит около 2 х 2000 тонких и 1000 толстых белковых нитей. В левой части рис. 11.5 показано образование толстой нити из приблизительно 200 молекул миозина. Тонкая нить образуется путем ассоциации 2 х 175 мономеров; глобулярного актина, 2 х 25 молекул тропомиозина и 2 х 25 звеньев трехкомпонентного белка тропонина. Нить актина представляет собой двойную спираль (разд. 5.1) с периодом идентичности от 360 до 370 Å [755, 758]. Саркомер — один из многих образующихся in vivo ансамблей макромолекул, имеющих пространственную группу симметрии.
Цикл образования мостиков — элементарный процесс сокращения мышц. Сокращение происходит в результате скольжения тонких нитей вдоль толстых нитей к центру саркомера [759, 760]. Сила между нитями возникает благодаря поперечным сшивкам, идущим от толстых нитей. Эти сшивки, называемые также миозиновыми головками, представляют собой биохимически активные участки молекулы миозина, которые взаимодействуют с Mg-ATP и с актином в так называемых поперечно-мостиковых циклах (рис. 11.6). Один мостик способен совершить от 10 до 100 циклов в секунду. Поскольку синхронизация циклов миозиновых головок (на саркомер их приходится целый миллион!) отсутствует, в результате возникает постоянно действующая сила и плавное движение.
Таблица 11.1 Клетка мышцы млекопитающего как система, в которой сигналы (нервные импульсы или присоединение гормона) приводят к контролируемому ответуa
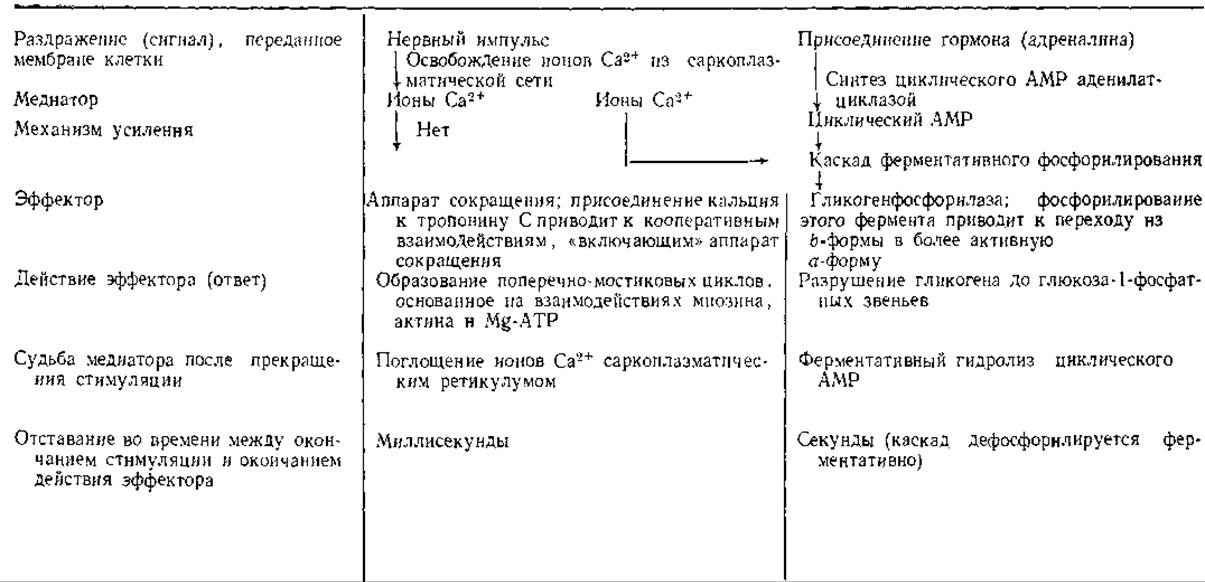
а Основная функция клетки состоит в движении, основанном на сокращении и расслаблении, и в выполнении механической работы. Вспомогательные функции относятся к запасанию химической энергии, предназначенной для превращения в механическую энергию. В этом плане важной стадией является мобилизация гликогена, выполняющего функцию хранения энергии.

Рис. 11.5. Структурная организация аппарата сокращения скелетной мышцы [754].
Как схематически показано внизу слева, молекула миозина (б и г) состоит из длинной суперспирализованной а-спирали, «хвоста», и двух глобулярных головок. «Хвост» образован тяжелыми цепями молекулы, которые вместе с четырьмя легкими цепями участвуют также в образовании обеих головок. Биполярные агрегаты молекул миозина, так называемые толстые филаменты (е). размещены в саркомерах (з). Тонкий филамент имеет длину 1200 нм и диаметр 10 им; его молекулярная масса 105. Полимеризация актина (а) приводит к длинным спиральным филаментам (F-актин). Два других белка, тропонин и тропомиозин, присоединяются к F-актину; в результате (пример самоагрегировання (754]) образуется тонкий филамеит (ж; длина 1000 им, диаметр 5 им, молекулярная массе 2,5x107). Тонкие филаменты прикрепляются к Z-дискам, отделяющим саркомеры друг от друга. Тонкие филаменты, выходящие из разных сторон Z-мембраны, имеют противоположную полярность. В сарком ере тонкие и толстые филаменты образуют гексагональную решетку (и). Как видно из электронных микрофотографий (предоставлены Хофманом), упорядоченность толстых и тонких филаментов близка к кристаллической (к). Миофибриллы (л), находящиеся на следующем уровне структурной иерархии, построены из саркомеров. Совокупность миофибрилл образует сократительный аппарат клетки мышцы.
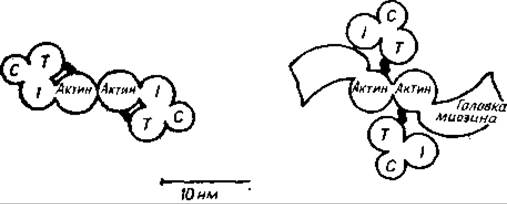
Рис. 11.6. Взаимодействия белков в аппарате сокращения [615].
Слева показано сечение тонкого филамента в состоянии расслабленна. С, I и Т — бельковые составляющие тропонинового комплекса. Тропомиозин блокирует связывающие центры головок миозина. При присоединении Са2+ к тропонину С тонкий филамент переключается в активное состояние (справа). Тропомиозин перемещается к центру желоба спирали актина, и головки миозина (поперечные мостики) могут взаимодействовать с актином. Цикл начинается с присоединения головки миозина к актиновому филаменту [755]. Затем миозин отклоняется, подтягивая активный филамент к центру саркомера (на рисунке — из плоскости бумаги) приблизительно на 80 Å. После этого АТР отделяет тонкий филамент от головки миозина, которая может начать другой цикл образования мостика далее по актиновому филаменту.
Сокращение основано на превращении химической энергии в механическую. Если мышца активирована, расход ее химической энергии в форме АТР увеличивается на один-два порядка. Один из предложенных механизмов состоит в следующем. В расслабленном состоянии мышцы актин и миозин не взаимодействуют и головка миозина характеризуется слабой АТРазной активностью, которая лимитируется стадией освобождения продуктов, главным образом Mg-ADP. В работающей мышце актин усиливает АТРазную активность миозина примерно в 100 раз путем вытеснения Mg-ADP. До сих пор не ясно, является ли действие актина на ADP-связывающий центр миозина прямым или аллостерическим.
«Ответ» АТРазы миозина показывает, что одинаково важны и действия белка и контроль над этим действием. Миозин проявляет АТРазную активность только при сокращении мышцы; высокая активность АТРазы в отсутствие взаимодействия актин — миозин была бы бессмысленной затратой химической энергии.
Большие времена жизни Mg2+-нуклеотидных комплексов могут объяснить их широкую распространенность в качестве субстратов. Для ответа на вопрос, почему физиологическим субстратом АТРазы миозина и многих других ферментов является Mg-ATP, а не Са-АТР, можно воспользоваться кинетическими данными. Константы стабильности Mg-нуклеотидных и Ca-нуклеотидных комплексов почти идентичны, но распад Са2+-комплексов происходит в 1000 раз быстрее, чем соответствующих Мg2+-комплексов [762]. Не кальций, а магний, полураспад АТР- и ADP-комплексов которого имеет порядок миллисекунд, был избран для подавления АТРазной активности миозина в состоянии расслабления мышцы и для проведения относительно медленных конформационных изменений (t1/2 > 1 мсек), которые происходят на стадиях каталитического действия АТРазы актин-активированного миозина, равно как и некоторых других ферментов [758].
Такой пример показывает, что для оценки влияния комплексов на действие белков должны быть изучены равновесные и кинетические свойства этих комплексов, а также их структурных изомеров. Для этой цели могут применяться методики изучения кинетики быстрых (10-7 с) и очень быстрых (10-9 с) реакций І763—766], скорости которых близки к скоростям процессов, протекающих под диффузионным контролем (10-10 с).