Принципы структурной организации белков - Г. Шульц 1982
Способы свертывания и ассоциации полипептидных цепей
Вторичная структура
Реверсивные повороты пептидной цепи
Пептидная цепь может образовывать резкие повороты, включающие водородную связь. При исследовании предпочтительных конформаций трех последовательно расположенных пептидных звеньев (от Сia до Сi+3a) Венкатачалам [199] обнаружил три структуры с водородной связью между атомами Оi и Ni+3. Они были названы реверсивными поворотами цепи I, II и III. Поворот III представляет собой участок описанной выше спирали 310 (рис. 5.4). Поворот I — это деформированная спираль 310, в которой углы (∅, ψ) правильной спирали приобретают несколько различные значения для Сi+1a и Сi+2a (рис. 5.7, а). У поворота II плоскость пептидной группы между остатками в положениях і + 1 и i + 2 резко меняет свою ориентацию (рис. 5.7, б) и углы (∅, ψ) при атомах и Сi+2a приобретают существенно отличные значения (рис. 5.7, а). Это ведет к серьезным стерическим затруднениям между атомом Оi+1 и боковой цепью остатка і+2; напряжения в цепи в случае поворота II не возникают, если в положении i+2 находится остаток Gly. Зеркальные отображения реверсивных поворотов I, II и III. называемые поворотами I', II' и III', невыгодны по стерическим причинам.
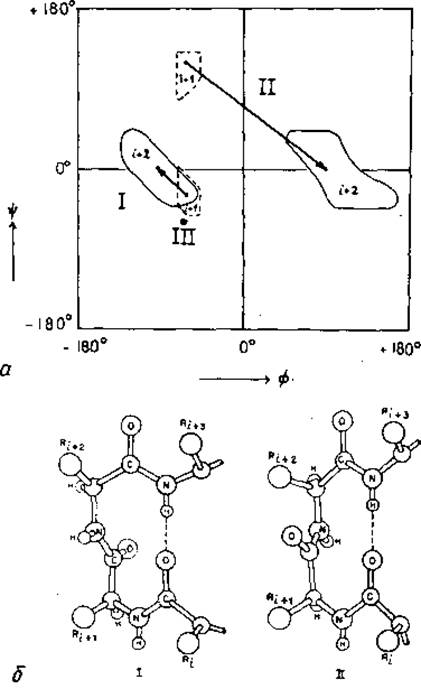
Рис. 5.6. Реверсивные повороты цепи.
а — области двугранных углов основной цепи остатков i+1 (пунктирная линия) и і+2 (сплошная линия) в реверсивных поворотах типа I, II и III [199]. Соответствующие области соединены стрелками. В случае поворота III обе области совпадают между собой и с положением 310-спирали (рис. 5.4). б — повороты типов І и II [326]. В типе II имеются стерические затруднения между боковой цепью Ri+2 и Oі+1, так что в положении остатка і+2 должен находиться Gly. Поворот типа III см. на рис. 5.4.
Реверсивные повороты цепи часто встречаются в белках. Анализ поворотов цепей в глобулярных белках показал, что они очень распространены и в их образовании участвует около одной четверти всех остатков [200, 201]. Далее, было выяснено, что повороты I, II и III составляют соответственно 35, 15 и 15% от их общего числа [202]. Как и следовало предполагать, почти все найденные повороты II содержат в положении і+2 остаток Gly. Общая распространенность зеркальных отображений (повороты I', ІI' и III'), как и ожидалось, низка и составляет 10%. Нестандартные реверсивные повороты, не содержащие водородных связей, встречаются с частотой 25%. Они идентифицируются с помощью более общего критерия, согласно которому расстояние между атомами Сiа и Сi+3a должно быть меньше 7 Å при иной, чем а-спираль, конформации основной цепи. Такой критерий включает все стандартные повороты цепи, однако допускает возможность и других реверсивных конформаций. Иногда нестандартные повороты содержат цис-Рrо; в частности Рrо-93 и Рrо-114 в рибонуклеазе [39], Рrо-168 в субтилизине [40] и Рrо-116 в нуклеазе стафилококка [41].
Большинство поворотов находится на поверхности белка. Анализируя расположение поворотов в белках, Кунтц [203] обнаружил, что они сконцентрированы на поверхности. В соответствии с таким расположением они содержат в основном гидрофильные остатки. Предполагается, что в процессе свертывания повороты играют только пассивную роль, образуя участки наименьшего сопротивления невалентным силам, стремящимся изогнуть цепь. Это предположение подтверждается большим разнообразием наблюдаемых поворотов, ни один из которых не имеет особенно стабильной конформации.