Принципы структурной организации белков - Г. Шульц 1982
Модели, изображение и документация белковых структур
Абстрактные представления о свертывании цепи
Карты расстояний между Са-атомами
Свертывание цепи можно представить картами расстояний Са—Са. Координаты атомов Са, определяющие свертывание цепи, полностью задаются картой расстояний между атомами Са, поскольку все координаты (кроме трех) можно легко получить из этих расстояний тригонометрически*. На карте взаимных Са-расстояний в определенных областях точки располагаются чрезвычайно близко друг к другу. Поэтому можно использовать контурные изолинии равных расстояний, аналогичные контурам на карте электронной плотности. Таким способом можно представить свертывание цепи с помощью двумерного графа.
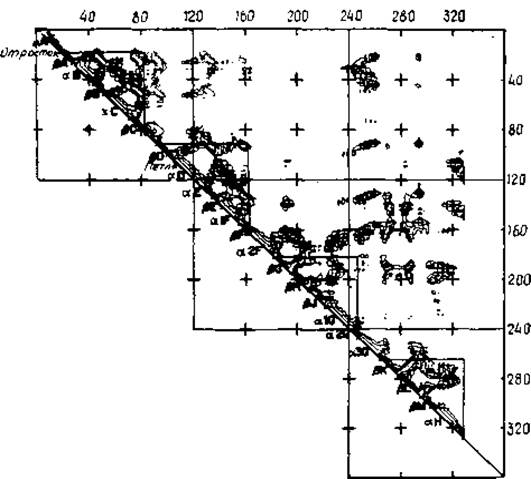
Рис. 7.11. Диаграмма межостаточных контактов лактатдегидрогеназы [407]. Расстояния между Сa-атомами i-го и j-то остатков представляются треугольной матрицей. Результаты даны не в цифровом, а в контурном виде; контуры проведены при 16, 12, 8 и 4 Å. Различные структурные элементы идентифицируются относительно диагонали; треугольники отвечают четырем геометрически хорошо выделяющимся полудоменам. Два треугольника со стороны N-конца представляют ßaßaß-звенья.
Вторичные структуры обнаруживаются по характерным областям на карте расстояний. a-Спиралям соответствуют малые расстояния (много контурных линий) вдоль диагонали, параллельным ß-складчатым листам — малые расстояния вдоль линий, параллельных диагонали (рис. 7.11). Для антипараллельных ß-складчатых листов, а также реверсивных поворотов характерны области малых расстояний в направлениях, перпендикулярных диагонали [406]. Расположение линий на карте Са-расстояний является своеобразным «отпечатком пальца» укладки цепи. Более того, включения и делеции лишь частично нарушают общий рисунок за счет включения или вычеркивания строчки матрицы. Поэтому такие карты можно использовать для сопоставления свертывания цепей [407].
* При наличии N∙(N + 1)/2 расстояний, (т. е. уравнений) для 3-(N — — 1) неизвестных координат задача может быть решена однозначно для трех Са-атомов и оказывается переопределенной для четырех и более Са-атомов.
Другие зависимости. График корреляции соседних остатков на рис. 5.14, а также представляет собой не что иное, как весьма своеобразный график расстояний Са. Однако с его помощью невозможно получить исходные координаты.
Льюис и сотр. [202] построили график зависимости расстояний между Саi и Сi+3 от порядкового номера і. Такой график позволяет выявить все повороты полипептидной цепи (разд. 5.1); он имеет также то преимущество, что указывает повороты, которые не отвечают типам, перечисленным Венкатачаламом [199]. Однако в этом случае также нельзя вернуться к исходным координатам, поскольку имеется только N—3 расстояний для 3N—3 координат.
График радиальных расстояний от данной точки молекулы, например остатка Тrр, может представить интерес при соответствующем спектральном исследовании. На таком графике цепь развернута по замкнутому кругу и расстояния от всех атомов Саi до выбранной точки наносят радиально.
Схематичный график расстояний, представляющий перечень контактов между атомами различных субъединиц олигомерного белка, показан на рис. 5.18, г.
Все рассмотренные в этом разделе графики расстояний Сa легко запрограммировать, пользуясь Са-координатами, предоставляемыми, например, «банком» данных о белках [390].