Принципы структурной организации белков - Г. Шульц 1982
Структурная роль пептидной связи
Параметры пептидной связи
Вращение вокруг пептидной связи заторможено. Геометрические параметры пептидной связи приведены на рис. 2.1, а. Эти данные получены Полингом и Кори [25] на кристаллических структурах молекул, содержащих одну или несколько пептидных связей. Наиболее неожиданным оказалось малое расстояние между атомами С' и N, которое на 0,15 Å, или на 10%, короче обычного. Кроме того, двойная связь С'—О на 0,02 Å длиннее, чем в альдегидах и кетонах [26]. Полинг и сотр. объяснили этот эффект резонансом двух предельных структур, показанных на рис. 2.1, б. В структуре I связь С' — N включает только σ-электроны, аксиальная симметрия которых допускает свободное вращение, тогда как в структуре II σ- и п-электроны связи С'—N приводят к большому дипольному моменту и к заторможенности вращения.
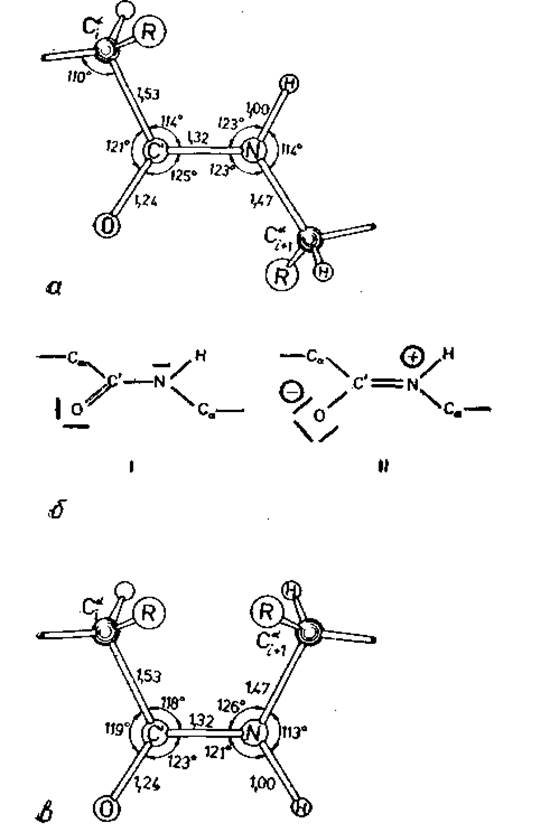
Рис. 2.1. Амидная или пептидная связь [29]. а — валентные углы и расстояния для транс-пептидной связи по данным Полинга и Кори [25]. Атомы С' и N находятся в плоскости, б — две предельные электронные структуры связи; форма I допускает свободное вращение; у формы II, имеющей большой дипольный момент, вращение заторможено. Гибридная структура состоит на 60% из формы I и на 40% из формы II, что следует из длины связи С'—N. энергия резонанса около 20 ккал/моль. в — валентные углы и межатомные расстояния в редко встречающейся циc-пептидной связи.
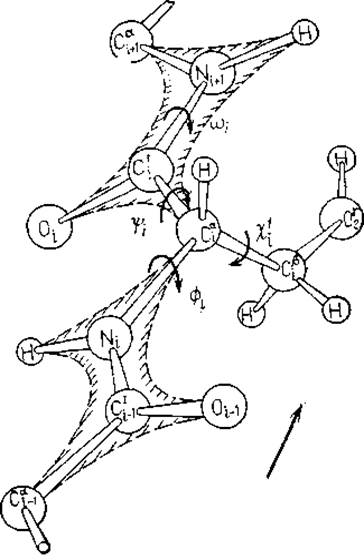
Рис. 2.2. Определение двугранных углов в полипептидной цепи; направление цепи указано. Для иллюстрации определения двугранных углов боковой цепи использован остаток Ser.
Обозначение следует рекомендациям комиссии IUPAC—IUB от 1969 г. [21]. При обозначении прочих двугранных углов в боковых цепях следует обращаться к этим рекомендациям. Нулевые значения двугранных углов определены следующим образом:
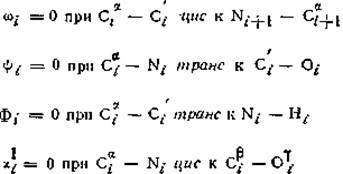
В приведенной основной цепи углы равны φі = 180° и ψі = 180°. Чак показано штриховкой, обычно шесть атомов Саі, С'і, ύі, Nі+1, Саі+1, Ні+1 расположены в одной плоскости, т. е. угол ω равен 180°. Ні и Ні+1 — атомы водорода амидной группы. Указанные направления вращения ω, ψ и φ положительны, если смотреть со стороны атома на N-конце данной пептидной связи и вращать С-конец этой связи в направлении, указанном стрелками (по часовой стрелке). Это же определение относится к χ. если смотреть, от атома, ближайшего к Са-атому.
Судя по различию в длинах связей, результирующая гибридная структура включает формы I и II в отношении 3 : 2, с п-электронами, делокализованными по связям С'—О и С'—N. Термодинамические данные показывают, что энергия резонанса составляет около 20 ккал/моль [23]. Поскольку структура II плоская, гибридная структура также плоская, т. е. шесть атомов Cаі, Сі, Оі, Nі+1, Hі+1, Саі+1 (рис. 2.2) находятся в одной плоскости.
Каждый остаток в основной цепи полипептида описывается двумя двугранными углами. При жесткой пептидной связи и довольно жестких длинах связей и валентных углах, конформация полипептидной цепи по существу описывается двугранными углами — и ψ при Са-атомах, как показано на рис. 2.2. Это описание соответствует номенклатуре IUРАС — IUВ от 1969 г. [21]. Введен и торсионный угол (о, хотя вращение вокруг связи С' —N заторможено. Все двугранные углы в боковых цепях обозначаются буквой χ с индексом, который может меняться от единицы до пяти. Показанная на рис. 2.2 боковая цепь Ser не имеет разветвлений, поэтому здесь потребовался только один индекс. Исчерпывающее описание обозначений можно найти в рекомендациях IUРАС—IUВ [21].
Следует упомянуть, что ранее, в 1966 г., для двугранных углов — и ψ основной цепи было полуофициально введено другое начало - отсчета [27]:
![]()
Поскольку за время между этими двумя датами появилось довольно много публикаций по определению белковых структур, то старое обозначение все еще можно иногда встретить в литературе.